Замедленность - электрохимическая стадия
Cтраница 1
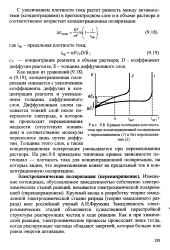 |
Кривые потенциал-плотность тока при концентрационной поляризации с перемешиванием ( 7 и без перемешивания ( 2. [1] |
Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации. [2]
 |
Зависимость электрохимической поляриза ции электрода от lg (. [3] |
Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая выше среднего уровня энергии молекул. Разность между энергией реагирующей частицы и средней энергией молекулы называется энергией активации. Частицы, энергия которых больше или равна энергии активации, называются активными. Только активные частицы способны к эффективному взаимодействию на электроде. Скорость электрохимических реакций, как и химических реакций, может быть увеличена повышением температуры и применением катализатора. При повышении температуры растет доля активных молекул, при применении катализатора снижается энергия активации. [4]
Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации. [5]
Электродная поляризация, вызванная замедленностью элементарных электрохимических стадий. [6]
Коэффициент b при выделении водорода на платине по наиболее точным измерениям равен около 0 03, что также свидетельствует против замедленности чисто электрохимической стадии, так как коэффициент переноса а не может быть больше единицы. [7]
Величина коэффициента b при выделении водорода на платине по наиболее точным измерениям составляет около 0 03, что также свидетельствует против замедленности чисто электрохимической стадии, так как коэффициент переноса а не может быть больше единицы. При выделении водорода на платине стехиометрическое число vs равно единице. [8]
Преобладание того или иного зида перенапряжения определяется природой металла, составом оаствора, плотностью тока, температурой электролита. При обычных температурах и при использовании простых, некомплексных электролитов перенапряжение изменяется с природой металлов, как это показано в табл. 22.1. Опытные данные указывают на то, что выделение металлов, стоящих в начале ряда ( Hg, Ag, Tl, Pb, Cd, Sn), сопровождается лишь незначительной поляризацией, связанной главным образом с замедленностью возникновения и развития повой фазы. Замедленность электрохимической стадии не играет здесь существенной роли. В электрохимической литературе эти металлы, для которых характерно фазовое перенапряжение, называются часто нормальными металлами. Напротив, при выделении металлов, стоящих в конце ряда табл. 22.1 ( металлы группы железа), наблюдается высокая поляризация, обусловленная преимущественно замедленностью электрохимической стадии. Эти металлы, для которых характерно электрохимическое перенапряжение, называются инертными металлами. [9]
Преобладание того или иного вида перенапряжения определяется природой металла, составом раствора, плотностью тока, температурой электролита. Опытные данные указывают на то, что выделение металлов, стоящих в начале ряда ( Hg, Ag, Tl, Pb, Cd, Sn), сопровождается лишь незначительной поляризацией, связанной, главным образом, с замедленностью возникновения и развития новой фазы. Замедленность электрохимической стадии не играет здесь существенной роли. В электрохимической литературе эти металлы, для которых характерно фазовое перенапряжение, называются часто нормальными металлами. Напротив, при выделении металлов, стоящих в конце ряда табл. 48 ( металлы железной группы), наблюдается высокая поляризация, обусловленная преимущественно замедленностью электрохимической стадии. Эти металлы, для которых характерно электрохимическое перенапряжение, называются инертными металлами. [10]
Преобладание того или иного вида перенапряжения определяется природой металла, составом раствора, плотностью тока, температурой электролита. При обычных температурах и при использовании простых, некомплексных электролитов перенапряжение изменяется с природой металлов, как это показано в табл. 22.1. Опытные данные указывают на то, что выделение металлов, стоящих в начале ряда ( Hg, Ag, Tl, Pb, Cd, Sn), сопровождается лишь незначительной поляризацией, связанной главным образом с замедленностью возникновения и развития новой фазы. Замедленность электрохимической стадии не играет здесь существенной роли. В электрохимической литературе эти металлы, для которых характерно фазовое перенапряжение, называются часто нормальными металлами. Напротив, при выделении металлов, стоящих в конце ряда табл. 22.1 ( металлы группы железа), наблюдается высокая поляризация, обусловленная преимущественно замедленностью электрохимической стадии. Эти металлы, для которых характерно электрохимическое перенапряжение, называются инертными металлами. [11]
Фольмера ( 1930) представление о замедленности электрохимической стадии было впервые количественно оформлено применительно к конкретной реакции выделения водорода. Герни ( 1931) сделал первую попытку квантовомеханического рассмотрения процесса переноса электрона через границу раздела фаз. Он пришел к выводу, что разряд иона водорода происходит по туннельному механизму путем перескока электрона с некоторого энергетического уровня в металле на ион в растворе. В 50 - х годах идея туннельного переноса как электрона, так и протона была использована С. [12]
Фоль-мера ( 1930 г.) представление о замедленности электрохимической стадии было впервые количественно оформлено применительно к конкретной реакции выделения водорода. Герни ( 1931 г.) сделал первую попытку квантовомеханиче-ского рассмотрения процесса переноса электрона через границу раздела фаз. Он пришел к выводу, что разряд иона водорода происходит по туннельному механизму путем перескока электрона с некоторого энергетического уровня в металле на ион в растворе. [13]
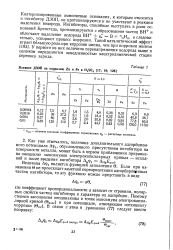 |
Влияние ДЗОП на коррозию Zn и Ре в H2S04. [14] |
Кватернизированные аммониевые основания, к которым относится и ингибитор ДЗОП, не протонизируются и не участвуют в реакции выделения водорода. Ингибиторы, способные выступать в роли оснований Бренстеда, протонизируются с образованием частиц ВН и облегчают выделение водорода ВН ей В V2H2, а следовательно, ускоряют процесс коррозии. У первого из них величина перенапряжения водорода выше и целиком определяется замедленностью электрохимической стадии переноса заряда. [15]
Страницы: 1 2