Потенциал - разряд - ион - натрий
Cтраница 1
Потенциал разряда ионов натрия имеет более положительное значение, чем обратимый потенциал атрия, за счет образования амальгамы и непрерывного отвода ее с поверхности вследствие растворения в избытке ртути. [1]
Поддержание большой концентрации хлористой соли в анолите, так как при этом уменьшается растворимость хлора в электролите и понижается потенциал разряда иона натрия. [2]
Концентрация исходного хлорида натрия в рассоле, поступающем на электролиз с ртутным катодом, не отличается от концентрации рассола, подаваемого в электролизер с твердым катодом и фильтрующей диафрагмой. Это обусловлено зависимостью потенциала разряда ионов натрия и хлора от их активности в растворе, а также растворимостью хлора, которая существенно зависит от концентрации исходной соли. Снижение концентрации хлорида сопровождается увеличением растворимости молекулярного хлора в рассоле и возрастанием скорости его восстановления на катоде. [3]
На рис. 2.15 приведены поляризационные кривые выделения водорода и натрия при различном содержании натрия в амальгаме. На основании данных рис. 2.15 можно сделать следующие выводы: 1) потенциал катода сдвигается в сторону более отрицательных значений с ростом концентрации натрия в амальгаме; 2) потенциал выделения водорода имеет более отрицательное значение, чем потенциал разряда ионов натрия лишь в нейтральных растворах; в кислых растворах при рН3 - на катоде выделяется водород, так как потенциал его выделения более положительный, чем потенциал разряда ионов натрия; 3) поляризация при разряде ионов натрия практически не зависит от плотности тока. [4]
На рис. 2.15 приведены поляризационные кривые выделения; водорода и натрия при различном содержании натрия в амальг-гаме. На основании данных рис. 2.15 можно сделать следующие выводы: 1) потенциал катода сдвигается в сторону болев отрицательных значений с ростом концентрации натрия В; амальгаме; 2) потенциал выделения водорода имеет более отрицательное значение, чем потенциал разряда ионов натрия-лишь в нейтральных растворах; в кислых растворах при рН на катоде выделяется водород, так как потенциал его выделения более положительный, чем потенциал разряда ионов натрия; 3) поляризация при разряде ионов натрия практически не-зависит от плотности тока. [5]
На рис. 2.15 приведены поляризационные кривые выделения водорода и натрия при различном содержании натрия в амальгаме. На основании данных рис. 2.15 можно сделать следующие выводы: 1) потенциал катода сдвигается в сторону более отрицательных значений с ростом концентрации натрия в амальгаме; 2) потенциал выделения водорода имеет более отрицательное значение, чем потенциал разряда ионов натрия лишь в нейтральных растворах; в кислых растворах при рН3 - на катоде выделяется водород, так как потенциал его выделения более положительный, чем потенциал разряда ионов натрия; 3) поляризация при разряде ионов натрия практически не зависит от плотности тока. [6]
С большинством электродов электролиз рассола дает водород на катоде и хлор на аноде ( разд. При ртутном катоде из-за перенапряжения повышается отрицательный потенциал, необходимый для разряда ионов водорода. В то же время потенциал разряда ионов натрия снижается, что приводит к образованию амальгамы натрия. Амальгама направляется в камеру с водой, при реакции с которой получается гидроксид натрия и водород. [7]
Из табл. 53 видно, что скорость удаления натрия из поверхностного слоя при данных условиях перемешивания отстает от скорости разряда ионов натрия. Поэтому можно предвидеть, что в некоторых условиях электролиза возможно такое обогащение поверхностного слоя амальгамы натрием, что потенциал катода возрастет до потенциала разряда водорода, который начнет выделяться в заметном количестве. Причиной этого является не только то, что потенциал разряда ионов натрия становится более отрицательным, но и то, что перенапряжение водорода на натриевой амальгаме меньше, чем на чистой ртути; это уменьшение перенапряжения тем значительнее, чем выше концентрация амальгамы. [8]
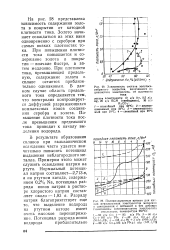 |
Зависимость состава золотосе-ребряного покрытия, полученного из цианистого электролита, от плотности. [9] |
В результате образования сплавов при гальваническом осаждении часто удается значительно повысить потенциал выделения неблагородного металла. Примером этого может служить осаждение натрия на ртути. Нормальный потенциал натрия составляет-2 713 в, а на ртутном катоде, содержанием 0 2 / 0 Na, потенциал разряда ионов натрия в растворе хлористого натрия составляет около - - 1 83 в. Разряду натрия благоприятствует еще то, что выделение водорода на ртутном катоде имеет очень высокое перенапряжение. [10]
Страницы: 1