Потенциал - разряд - водород
Cтраница 1
 |
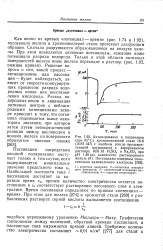
Кривые зависимости катодного потенциала от времени при восстановлении пленок окисел - сульфид на меди н серебре ( Кэмпбелл и Томас. [1] |
Потенциал разряда водорода характеризуется последними горизонтальными участками обеих кривых. [2]
С уменьшением концентрации ионов водорода в растворе потенциал разряда водорода на катоде становится более электроотрицательным, и растет выход металла по току. Создание при электролизе условий, затрудняющих выделение водорода на катоде, важно еще и потому, что осаждаемые металлы, например, никель или хром, часто склонны к поглощению водорода; при этом изменяются физические свойства металла, создаются внутренние напряжения, приводящие к растрескиванию покрытия и шелушению его. [3]
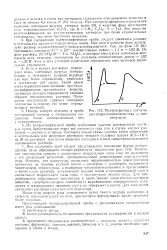 |
Полярограммы с аномальным возрастанием силы тока - максимумами. [4] |
Если в водных растворах определяют ноны, потенциал разряда которых близок к потенциалу разряда водорода или еще более отрицателен, прибегают к изменению рН среды. Такой прием имеет первостепенное значение при поля-рографировании органических веществ, потенциал которых определяется главным образом кислотностью раствора. Повышение кислотности сдвигает потенциал полуволны в сторону его менее отрицательных значений. [5]
В некоторых случаях при подготовке пробы для полярографирования прибегают к изменению рН среды, например, когда в водных растворах определяют ионы, потенциал разряда которых близок к потенциалу разряда водорода или является еще более отрицательным. [6]
Поэтому, несмотря на присутствие ионов Н, могут быть выделены такие металлы, как Fe, Sn, Pb, Zn и др., величины потенциалов разряда которых оказываются меньше потенциала разряда водорода при перенапряжении. [7]
 |
Схема установки для электролиза при контролируемом потенциале. [8] |
При высокой плотности тока скорость разряда ионов металла большая, прикатодное пространство обедняется, так как не успевает пополняться ионами за счет диффузии и потенциал катода смещается в отрицательную область ( концентрационная поляризация), в результате чего может быть достигнут потенциал разряда водорода. Водород, выделяясь совместно с металлом, разрыхляет осадок. Рыхлый губчатый осадок плохо сцепляется с электродом, легко окисляется. [9]
С ростом плотности тока выход родия по току увеличивается, проходит через максимум и далее уменьшается из-за увеличения скорости выделения водорода. Чем выше концентрация родия, тем при более высоких плотностях тока достигаются потенциал разряда водорода и соответственно максимальная величина выхода по току. [10]
Из табл. 53 видно, что скорость удаления натрия из поверхностного слоя при данных условиях перемешивания отстает от скорости разряда ионов натрия. Поэтому можно предвидеть, что в некоторых условиях электролиза возможно такое обогащение поверхностного слоя амальгамы натрием, что потенциал катода возрастет до потенциала разряда водорода, который начнет выделяться в заметном количестве. Причиной этого является не только то, что потенциал разряда ионов натрия становится более отрицательным, но и то, что перенапряжение водорода на натриевой амальгаме меньше, чем на чистой ртути; это уменьшение перенапряжения тем значительнее, чем выше концентрация амальгамы. [11]
Как видно из кривых потенциал - время ( рис. 1.74 и 1.92), пассивация железа и хромоникелевой стали протекает следующим образом. Сначала разрушаются образовавшиеся на воздухе окислы. При этом появляются активные потенциалы, лежащие ниже потенциала разряда водорода. Решение вопроса о том, какой процесс - активирование или пассивация - будет наблюдаться, зависит от скорости конкурирующих процессов: разряда водородных ионов или восстановления кислорода. [13]
Эффективность использования электрохимических методов выделения и разделения радиоактивных элементов определяется для каждой данной системы как соотношением потенциалов выделения разделяемых элементов, так и величиной этих потенциалов по отношению к потенциалу выделения водорода. Достаточная полнота разделения может быть достигнута лишь при условии, что потенциалы выделения элементов, с учетом их концентраций, заметно отличаются друг от друга. Если величина потенциала выделения элемента значительно более отрицательна, чем потенциал разряда водорода, то такой элемент может быть выделен из водного раствора только в виде амальгамы или тонкого слоя гидроокиси. В элементарном состоянии радиоактивный элемент может быть выделен электролизом расплава. [14]
Для выделения водорода на ртути необходима, следовательно, значительная поляризация катода. Так, например, из нейтрального раствора, в котором обратимый потенциал водорода равен - 0 415 в, сколько-нибудь заметное выделение водорода возможно лишь при потенциале катода около 1 26 в. Вследствие этого ион Na, для которого равно-весный потенциал в нормальном растворе его соли равен - 2 7 в, разряжается в заметных количествах уже при потенциале ртутного катода, равном - 1 2 в. Фактически выделение водорода при электролизе хлористых натрия и калия происходит не из нейтрального раствора, а из слабощелочного, образующегося в непосредственной близости от катода уже в первые моменты электролиза. Поэтому потенциал разряда водорода становится еще более отрицательным. [15]
Страницы: 1 2