Потенциал - обратимый электрод
Cтраница 1
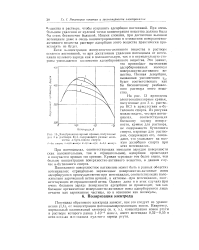 |
Электрокапиллярпые кривые, полученные для 3 н. раствора KCI, содержащего разные количества и-бутилового спирта. / - без спирта. 2 - 0 03 моля / л. 3 - 0 1 мнля / л. 4 - 0 3 моля / л. [1] |
Потенциал обратимого электрода зависит, как это следует из уравне нения ( 1 4), от концентрации потенциалопределяющих ионов. ЫО-6 моль / л, имеет потенциал 0 52 - 0 55 в относительно потенциала нулгвого заряда ртути. [2]
Чтобы определить потенциалы любого обратимого электрода, который состоит из металла М, погруженного в раствор, содержащий катионы М, этот электрод соединяют со стандартным водородным электродом. [3]
 |
Схема потенциометра [ IMAGE ] Схема лампового потенциометра. [4] |
Уравнение Нернста дает простое соотношение между потенциалом обратимого электрода и концентрацией определяемых ионов. Таким образом, измеряя потенциал обратимого электрода, можно вычислить активность или концентрацию данного вещества в растворе. [5]
Определение рН растворов электрометрическими методами основано на существующей зависимости изменения потенциала обратимого электрода от активной концентрации ионов водорода в растворе. [6]
Исходя из этого, можно определить, что стандартный электродный потенциал соответствует потенциалу обратимого электрода, если активность каждого компонента электродной реакции равна единице или если произведение активностей всех компонентов реакции равно единице. Как уже было сказано выше, в качестве такого условного нуля принят потенциал водородного электрода, а в некоторых случаях - каломельного. [7]
В равновесных условиях общая величина электродного потенциала металла при постоянной концентрации ионов тога же металла в растворе не зависит от строения двойного слоя Действительно, потенциал обратимого электрода определяется условиями равновесия и не зависит от того, каким путем это-равновесие достигается. [8]
Таким образом, измеряя потенциал обратимого электрода, можно вычислить активность или концентрацию данного вещества в растворе. [9]
 |
Схема потенциометра [ IMAGE ] Схема лампового потенциометра. [10] |
Уравнение Нернста дает простое соотношение между потенциалом обратимого электрода и концентрацией определяемых ионов. Таким образом, измеряя потенциал обратимого электрода, можно вычислить активность или концентрацию данного вещества в растворе. [11]
Приводятся значения от 0 5 до 3 0 в. Кроме того, указанная ранее величина 2 85 в является значением потенциала обратимого электрода при стандартных термодинамических условиях. Это, очевидно, не имеет места в электрохимическом процессе, так как образующийся фтор сразу же вступает в реакцию, что приводит к уменьшению его концентрации и, следовательно, к дальнейшему снижению потенциала. Поэтому механизм процесса с участием свободного фтора нельзя отвергнуть на том единственном основании, что применяемое напряжение слишком мало для выделения фтора. [12]
Более высокая степень комплексо-образования в случае тория дает основания предполагать, что осаждение тория ( за исключением очень низких плотностей тока) будет происходить за счет вторичного восстановления его литием. В соответствии с этим предположением при электролизе рассматриваемой системы предельный ток отсутствует, а величина потенциала в процессе стационарного осаждения почти равна потенциалу обратимого электрода ( Th Th4 - f - 4e -) при той же концентрации. Поэтому создается впечатление, что имеет место первичное осаждение Th4 1, которое, однако, осуществляется с большей скоростью, чем скорость, определяемая плотностью тока, которую можно получить за счет-ионов Th4 с концентрацией, определяемой константой нестойкости комплекса. [13]
Нахождение этой зависимости экспериментальным путем представляет определенные трудности, в особенности для сшитых полимеров. Предлагаются [3, 93-95] различные методы измерения потенциала, связанные с растворением или суспендированием полимеров, использованием медиаторов, с расчетом потенциала редоксита по потенциалу растворимого агента, снятием кривых лотенциометрического титрования и измерением потенциала твердых обратимых электродов из редокситов. [14]
Достоинства ртутного капельного электрода: идеально чистая, постоянно возобновляющаяся поверхность капающей ртути; идеальная воспроизводимость получаемых кривых и возможность достигнуть значительного перенапряжения водорода на поверхности ртути. Перенапряжение водорода наблюдается в том случае, когда потенциал обратимого электрода отличается от теоретически вычисленного. Перенапряжение зависит от плотности поляризующего тока. [15]
Страницы: 1 2