Изобарный потенциал - процесс
Cтраница 1
Изобарный потенциал процесса всегда уменьшается ( становится все более отрицательной величиной) с ростом константы равновесия, но при этом температура, при которой протекает процесс, должна оставаться постоянной. Для диссоциации воды с повышением температуры константа возрастает, но лога рифм константы, оставаясь отрицательной величиной, уменьшается по абсо. [1]
Аналогично и величина изобарного потенциала процесса превращения марганца от модификации альфа до жидкого состояния равна сумме изобарнйх потенциалов всех частных превращений. [2]
Обратите внимание, что с повышением температуры изобарный потенциал процесса диссоциации становится все более положительной величиной, в то же время константа диссоциации возрастает. Объяснение этого явления может быть предложено то же самое, как и в случае с водой. [3]
В частности, введены наряду с энтальпиями и энтропиями и изобарные потенциалы процессов. Преподавание современной неорганической химии невозможно без использования этих величин. Использование данных об окислительно-восстановительных потенциалах открывает широкие возможности для решения многих химических проблем и авторы считают обучение этому одной из важнейших задач курса общей и неорганической химии. Для выполнения данной задачи необходимы справочный материал и упражнения. Поэтому в приложении приведена обширная таблица окислительно-восстановительных потенциалов, составленная таким образом, чтобы ею было легко пользоваться, а в конце многих работ даны соответствующие контрольные вопросы. [4]
Повышение температуры на 100 град для любой концентрации раствора вызывает падение изобарного потенциала процесса в пределах 1 4 - 2 2 ккал / моль, в то время как снижение концентрации раствора от 1 0 до 0 1 % вызывает уменьшение AZ на 8 1 - 9 4 ккал / моль. Приведенные числовые примеры показывают, как существенен учет значений концентрации раствора при определении термодинамических характеристик процесса. [5]
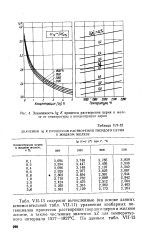 |
Зависимость lg ft процесса растворения церия в железе от температуры и концентрации церия. [6] |
VII-13 содержит вычисленные, ( на основе данных вспомогательной табл. VII-11) уравнения изобарных потенциалов процессов растворения твердого церия в жидком железе, а также численные значения Д7 для температурного интервала 1527 - 1827 С. [7]
Разность между обоими значениями изобарного потенциала Д7 - AZ - 7198 кал / моль представляет собой изобарный потенциал процесса плавления церия. [8]
В первых трех томах восьмитомника Химическая термодинамика в цветной металлургии [32, 59, 60] только для двух металлов - меди и цинка - приведены значения изобарных потенциалов процесса плавления. Для иных металлов, свойства которых описаны в этих трех томах, значения lg / С и А2ПЛ не приводятся. В предисловии к первому тому Я. И. Герасимов указывает, что это справочное руководство не содержит термодинамических данных для жидких металлических сплавов, окисных и сульфидных систем. [9]
Каждое из уравнений lg / С процесса плавления любого вещества при температуре плавления в градусах абсолютной шкалы обращается в нуль. Нулю равно и значение изобарного потенциала процесса плавления при температуре плавления. Применение этих уравнений имеет смысл лишь при температурах, превышающих температуру плавления. Назначение этих уравнений состоит в том, что они являются поправочными к расчетам равновесия тех реакций, участниками которых являются жидкие вещества. [10]
Как объяснить, что с повышением температуры изобарный потенциал процесса становится все более положительной величиной, хотя константа диссоциации возрастает. [11]
Как объяснить, что с повышением температуры изобарный потенциал процесса становится все более положительной величиной, хотя константа диссоциации возрастает. [12]
Страницы: 1