Стандартный потенциал - медь
Cтраница 1
Стандартные потенциалы меди в этих реакциях положительны. Это значит, что катионы меди в растворе находятся на более высоком энергетическом уровне, чем в металле, и, переходя на него, заряжают металл положительно. [1]
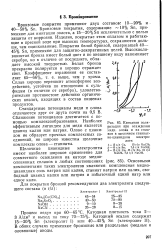 |
Катодная поляризация при осаждении меди, олова и их сплавов в щелочном станнат-но-цианидном электролите. [2] |
Стандартные потенциалы меди и олова отличаются друг от друга почти на 0 5 В. Сближение потенциалов достигается с помощью комплексообразования. Наиболее эффективным лигандом для меди является цианид калия или натрия. Олово с цианидом не образует прочных комплексных соединений, но широко известны щелочные комплексы олова - станнаты. [3]
Разность стандартных потенциалов меди и цинка довольно значительная - более 1 В, и поэтому для совместного выделения этих металлов используют растворы их комплексных соединений. В цианидных электролитах разность потенциалов выделения меди и цинка около 0 2 В, благодаря чему, изменяя условия электролиза, можно получать сплавы различных составов. Повышение концентрации в растворе свободного цианида приводит к обогащению его медью. Стабильности состава получаемых осадков способствует введение в цианидный раствор небольшого количества аммиака. [4]
Так как стандартный потенциал меди гораздо положитель-нее стандартного потенциала водородного электрода, коррозия меди с водородной деполяризацией не происходит. В отсутствие окислителей медь обладает хорошей стойкостью в водных растворах и в обычных условиях не вытесняет водород из кислот. [5]
Ввиду того что стандартный потенциал меди более положителен, чем железа, цинка, алюминия и их сплавов, медные покрытия не защищают электрохимически эти металлы от коррозии. Медные покрытия могут быть защитными при условии отсутствия в них пор и других повреждений, нарушающих целостность защитного слоя. [6]
Осаждение сплава медь - цинк затруднено тем, что стандартные потенциалы меди и цинка отличаются более, чем на 1 В. В настоящее время для получения электрохимического сплава медь-цинк предложены как комплексные, так и простые электролиты. В последнем случае, однако, удается получать осадки латуни толщиной до 1 мкм и только в присутствии ПАВ. [7]
Осаждение сплава медь - цинк затруднено тем, что стандартные потенциалы меди и цинка отличаются более, чем на 1 В. В настоящее время для получения электрохимического сплава медь - цинк предложены как комплексные, так и простые электролиты. Нсли при элсктроосаждении сплава из комплексных электролитов стремятся к сближению равновесных и катодных потенциалов путем изменения активности ионов, то при осаждении из растворов простых солей сближение достигается путем электроосаждения меди на предельном токе. В последнем случае, однако, удается получать осадки латуни толщиной до 1 мкм и только в присутствии ПАВ. [8]
Латуни, основными компонентами которых являются медь и цинк, осадить из растворов простых солей невозможно, так как разность стандартных потенциалов меди и цинка очень велика ( Ее. Однако в цианистых электролитах, где эти металлы находятся в виде комплексных соединений, потенциал осаждения меди равен - 0 763 В, а цинка - 1 1 В. Такое сближение потенциалов осаждения этих металлов делает возможным осаждение сплава, в данном случае - латуни. [9]
Хотя уравнения ( 37) и ( 38) являются точными уравнениями, качественные заключения, сделанные на основании этих уравнений, не всегда оказываются вполне правильными: например, стандартный потенциал меди относительно стандартного водородного электрода равен 0 340, и следовало бы ожидать, что медь не будет вытеснять водород из раствора. Однако известно, что медь растворяется в бромистоводородной кислоте и даже в растворе цианистого калия с выделением водорода. [10]
Контактная коррозия может возникнуть между двумя различными металлами, находящимися в контакте и погруженными в водную среду. Разность потенциалов между ними вызовет разъедание, причем скорость коррозии в значительной степени зависит от поверхностных реакций обоих металлов. Такие разности потенциалов на практике используются в гальванических элементах. В элементе Даниэля, содержащем растворы с активностями, равными единице ( стандартный потенциал меди, находящейся в контакте с двухвалентными ионами меди, равен 0 34 В, а цинка, находящегося в контакте с ионами цинка, равен - 0 77 В), возникает разность потенциалов 1 1 В. В большинстве случаев контактной коррозии ситуация сложнее, так как водные растворы не всегда содержат ионы с активностью, равной единице, а поверхность металла в значительной степени покрыта окисной пленкой. В этих условиях следует с осторожностью пользоваться электрохимическим рядом напряжений. Так, например, алюминий в этом ряду следует за цинком и по отношению к последнему должен быть анодным. [11]
Страницы: 1