Нормальный потенциал - хлор
Cтраница 1
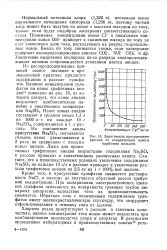 |
Зависимость прозрачности. [1] |
Нормальный потенциал хлора ( 1 326 в) несколько выше нормального потенциала кислорода ( 1 236 в), поэтому чистый хлор может быть получен на аноде с высоким выходом по току, только если будет подобран электролит соответствующего состава. Понижение концентрации ионов С1 - и повышение концентрации ионов ОН - приводят к снижению выхода по току за счет увеличения доли тока, расходуемого на разряд гидроксиль-ных ионов. Выход по току снижается также, если электролит содержит кислородсодержащие анионы: COi -, SO4 - C1O3 и др. Увеличение выделения кислорода из-за разряда кислородсодержащих анионов сопровождается усилением износа анодов. [2]
Нормальный потенциал хлора при с 1 и / 18 равен 1 36 вольта. [3]
Сродство этой реакции получают непосредственно из нормального потенциала хлора ( 1 36 е), используя уравнение ( 3) на стр. [4]
Сродство этой реакции получают непосредственно из нормального потенциала хлора ( 1 36 в), используя уравнение ( 3) на стр. [5]
Из приведенных в табл. 46 значений нормальных потенциалов ( с учетом нормального потенциала хлора) вычислены приведенные в табл. 47 потенциалы разложения хлоридов группы щелочноземельных металлов, относящиеся к водным растворам. [6]
На первый взгляд электрохимическое выделение брома кажется весьма выгодным, так как нормальный потенциал брома на 0 27 б ниже нормального потенциала хлора; следовательно, при электролизе рассола и щелоков, в которых наряду с бромистыми содержатся также и хлористые соли, ион брома будет разряжаться на аноде раньше иона хлора. [7]
На первый взгляд электрохимическое выделение брома кажется весьма выгодным, так как нормальный потенциал брома на 0 27 в ниже нормального потенциала хлора; следовательно, при электролизе рассола и щелоков, в которых наряду с бромистыми содержатся также и хлористые соли, ион брома будет разряжаться на аноде раньше иона хлора. [8]
Поскольку нормальный потенциал иода равен 0 52 в, а нормальный потенциал хлора равен 1 35 в, электролитическое выделение иода из хлоридных рассолов должно быть весьма выгодным. Однако вследствие низкой концентрации иода в буровых водах, щелочной их реакции и наличия примесей осуществление этого процесса сильно затрудняется. [9]
Нормальный потенциал, отнесенный к нормальному водородному электроду, в соответствии с уравнением ( 3) гл. Из приведенных в табл. 46 значений нормальных потенциалов ( с учетом нормального потенциала хлора) вычислены приведенные в табл. 47 потенциалы разложения хлоридов группы щелочноземельных металлов, относящиеся к водным растворам. [10]
Возможными процессами на аноде являются разряды ионов ОН и СГ. Сравнение кислородного и хлорного потен-циалов ( равновесный потенциал кислорода относительно нейтрального раствора равен 0 82 в, а нормальный потенциал хлора равен 1 36 в) показывает, что ионы ОН должны разряжаться на аноде легче, чем ионы СГ. Но на обычно применяемых в технике анодах ( графит, уголь пла-тина) кислород выделяется с большим перенапряжением. [11]
Страницы: 1