Обратимый потенциал - металл
Cтраница 1
Обратимые потенциалы металлов Мх и М2 в данном растворе, содержащем простые ионы обоих металлов, отличаются друг от друга на 0 3 в. Считая, что первым осаждается металл Mj, определить долю его, остающуюся в растворе в момент, когда при обычных температурах начинается осаждение металла М2 в случае: 1) если М - одновалентный металл и 2) если Ма - двухвалентный. [1]
 |
Коррозионные диаграммы, иллюстрирующие влияние различных факторов на скорость коррозии. [2] |
Чтобы обеспечить протекание коррозии, необходима разница между обратимым потенциалом металла и потенциалами анодной и катодной реакций, возможных в данных условиях, а не пространственное разделение катодных и анодных участков. Анодные и катодные реакции в зависимости от степени однородности границы раздела металл - среда могут протекать на одной и той же поверхности или на ее различных участках. [3]
Принципиальная возможность протекания процесса электрохимической коррозии металла определяется, таким образом, соотношением обратимого потенциала металла в данных условиях и обратимого потенциала катодного процесса в данных условиях. [4]
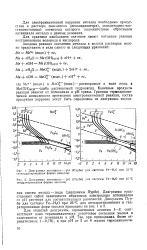 |
Диаграмма потенциал - рН ( Пурбе для системы Fe - Н2О при 25 С ( негидратированная форма окислов.| Диаграмма потенциал - рН ( Пурбе для системы Fe - Н2О при 25 С ( гидратированная форма окислов. [5] |
Для электрохимической коррозии металла необходимо присутствие в растворе окислителя ( деполяризатора), окислительно-восстановительный потенциал которого положительное обратимого потенциала металла в данных условиях. [6]
 |
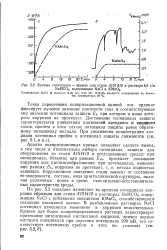
Поляризационные диаграммы электрохимической коррозии с водородной деполяризацией для пассивирующихся металлов. [7] |
Кривая / на рис. 17, а отвечает тому случаю, когда металл в отсутствие внешней поляризации находится в равновесии с собственными ионами ( идеализированная анодная кривая) и потенциал до наложения тока отвечает обратимому потенциалу металла ЫЕГ. При смещении потенциала в положительную сторону скорость растворения металла увеличивается и достигает максимального значения при Е Ен. [8]
 |
Кривые потенциал - время для стали AISI410 в растворе 8 3 г / л NaHC03, содержащем NaCl и КМп04. [9] |
Точка пересечения поляризационной кривой оси ординат фиксирует нулевое значение плотности тока и соответствующее ему значение потенциала защиты Е3, при котором и ниже которого коррозия не протекает. Достижение потенциала защиты характеризуется равенством плотностей катодного и анодного токов, причем в этом случае потенциал защиты равен обратимому потенциалу металла. [10]
В [ ( Ук) обр - обратимый потенциал катодной реакции в данных условиях, В; ( Va) a6p - ( VMe) 06P - обратимый потенциал металла в данных условиях ( для сплавов - обратимый потенциал анодной составляющей сплава в данных условиях, В ]; F 23062 кал / г-экв - число Фарадея. [11]
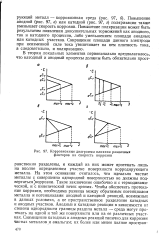 |
Коррозионные диаграммы влияния различных факторов на скорость коррозии. [12] |
На этом основании считалось, что идеально чистые металлы с совершенно однородной поверхностью не должны под-вергаться коррозии. Такое заключение ошибочно и с термодинамической, и с кинетической точек зрения. Чтобы обеспечить протекание коррозии, необходима разница между обратимым потенциалом металла и потенциалами анодной и катодной реакций, возможных в данных условиях, а не пространственное разделение катодных и анодных участков. Анодные и катодные реакции в зависимости от степени однородности границы раздела металл - среда могут протекать на одной и той же поверхности или на ее различных участках. [13]
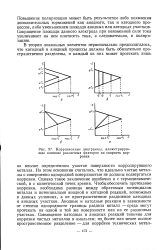 |
Коррозионные диаграммы, иллюстрирующие влияние различных факторов на скорость коррозии. [14] |
На этом основании считалось, что идеально чистые металлы с совершенно однородной поверхностью не должны подвергаться коррозии. Однако такое заключение ошибочно и с термодинамической, и с кинетической точек зрения. Чтобы обеспечить протекание коррозии, необходима разница между обратимым потенциалом металла и потенциалами анодной и катодной реакций, возможных в данных условиях, а не пространственное разделение катодных и анодных участков. Анодные и катодные реакции в зависимости от степени однородности границы раздела металл - среда могут протекать на одной и той же поверхности или на ее различных участках. [15]
Страницы: 1