Стационарный потенциал - нержавеющая сталь
Cтраница 1
Стационарный потенциал нержавеющих сталей, находящихся в пассивном состоянии фот, лежит ниже потенциала полной пассивации фп. В), и склонность нержавеющих сталей к питтинго-вой коррозии должна определяться разностью между потенциалом активирования и стационарным потенциалом фа - фст. [1]
Стационарный потенциал нержавеющих сталей, находящихся в пассивном состоянии фст, лежит ниже потенциала полной пассивации фп. В), и склонность нержавеющих сталей к питтинго-вой коррозии должна определяться разностью между потенциалом активирования и стационарным потенциалом фа - фст - Чем эта разность больше, тем труднее сталь будет подвергаться питтинговой коррозии. [2]
 |
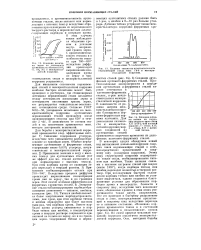
Схематическое изображение анодных кривых для основной части зерна ( / и границ зерен ( / / ( 8 ] однофазной нержавеющей стали. [3] |
Если стационарный потенциал нержавеющей стали находится между ф ] и ф2, то границы зерен поляризуются катодно, а тело зерна находится в активном состоянии и корродирует. [4]
Для выявления склонности нержавеющих сталей к межкристаллитной коррозии наиболее быстрое испытание может быть проведено в растворах, где стационарный потенциал нержавеющей стали находится между потенциалом пассивации зерна и потенциалом пассивации границ зерна, что регулируется окислительно-восстано-вит. Согласно ГОСТ ( 1032 - 58, ускоренные испытания на меж-кристаллитную коррозию аустеиитных нержавеющих сталей проводятся после провоцирующего отпуска при 650 в течение 2 час. В зависимости от состава сталей и их назначения применяется неск. [6]
 |
Влияние величи - - ii.| Влияние титана на чувствительность нержавеющей стали типа 18 - 8 к межкристаллитной коррозии. [7] |
Для выявления склонности нержавеющих сталей к межкристаллитной коррозии наиболее быстрое испытание может быть проведено в растворах, где стационарный потенциал нержавеющей стали находится между потенциалом пассивации зерна и потенциалом пассивации границ зерна, что регулируется окислительно-восстано-вит. Согласно ГОСТ 6032 - 58, ускоренные испытания на меж-кристаллитную коррозию аустенитных нержавеющих сталей проводятся после провоцирующего отпуска при 650 в течение 2 час. В зависимости от состава сталей и их назначения применяется неск. [8]
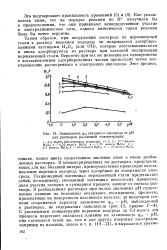 |
Зависимость фст стального электрода от рН для растворов различной концентрации. [9] |
В концентрированных же растворах, представляющих для нас больший интерес, преимущественно происходит восстановление перекиси водорода через адсорбцию на поверхности электрода. Стационарный потенциал нержавеющей стали представляет собой, по-видимому, смешанный потенциал нескольких процессов, доля участия которых в суммарном процессе зависит от состава раствора. [10]
Проведенные исследования показали, что и в щелочных хлорид-ных растворах при высоком содержании хлорида возможна анодная активация поверхности всех исследуемых нержавеющих сталей ионами хлора. При понижении концентрации щелочи процесс анодной активации облегчается и потенциал анодной активации смещается в отрицательную сторону, к стационарному потенциалу нержавеющих сталей. Таким образом, возрастает склонность всех исследованных сталей к локальной активации ионами хлора. [11]
 |
Изменение значения потенциала цинкового электрода во времени при постоянной плотности тока ( 0 05 А. [12] |
Ионы тяжелых металлов, особенно свинца, уменьшают не только общую коррозию, но и локальную. При эффективных концентрациях ионов свинца ( 10 - 6 - 10 - 4 моль / л) равновесные потенциалы свинца отрицательнее стационарного потенциала нержавеющей стали и поэтому контактное выделение с образованием фазового осадка здесь исключено и на поверхности стали возникает лишь субмономолекулярный слой свинца. [13]
Коррозионная стойкость нержавеющих сталей определяется величиной стационарного потенциала и его расположением по отношению к значениям критич. Значение стационарного потенциала соответствует точке пресечения катодной кривой с кривой анодной поляризации. Еаер отмечены значения стационарного потенциала нержавеющей стали соответственно в активном, пассивном состоянии и состоянии перепассивадии. Из этой диаграммы следует, чтагв зависимости от величины окислителыш-вву ановит. [15]
Страницы: 1 2