Компромиссный потенциал
Cтраница 2
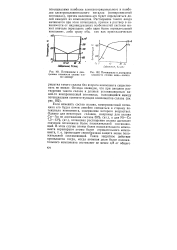 |
Потенциалы и диаграммы плавкости сплава олово-висмут.| Потенциалы и диаграмма плавкости сплава медь-золото. [16] |
Если изменять состав сплава, компромиссный потенциал его будет почти линейно смещаться в сторону потенциала компонента, содержание которого возрастает. [17]
С другой стороны, сдвиг компромиссного потенциала в положительную сторону тормозит восстановление ионов водорода ( или воды) на обоих металлах. Общее количество выделившегося водорода может расти или уменьшаться во времени в зависимости от величиг ны разности ащ и ан2, скорости увеличения площади электроположительного металла и величины смещения компромиссней. [18]
 |
Потенциалы, устанавливающиеся на электролитическом. [19] |
Из данных рис. 134 видно, что наблюдаемые компромиссные потенциалы зависят от рН раствора. Это находится в соответствии с изменением потенциала восстановления кислорода, растворенного в воде, в зависимости от изменения рН раствора. [20]
 |
Диаграмма пятиэлектродной коррозионной системы. [21] |
В конечном счете характер протекания коррозии определяется величиной компромиссного потенциала. [22]
Многофазный сплав при погружении в раствор электролита приобретает некоторый компромиссный потенциал, зависящий от электрохимических свойств отдельных фаз, но практически мало отличающийся от потенциала наиболее электроотрицательной фазы, если только содержание этой последней не слишком мало. При этом не имеет значения, является ли такой фазой чистый металл, твердый раствор или интерметаллическое соединение. [23]
Если, несмотря на поляризацию, установившийся на аноде компромиссный потенциал все же отрицательнее потенциала более положительного компонента сплава, то перешедшие в раствор ионы этого металла вновь восстанавливаются частицами металлического шлама либо непосредственно на поверхности анода. [24]
На рис. 5.4 показаны значения потенциалов на границах зерен относительно компромиссного потенциала коррозии для двух сплавов, погруженных в аэрированный нейтральный 1 М раствор NaCl. [25]
При анодной и катодной поляризации электрода аналогично равновесному изменяется и компромиссный потенциал. В этом случае отклонение электродного потенциала от значений равновесных потенциалов приводимых реакций называется не перенапряжением, а поляризацией г фп - фкп, где фп - потенциал поляризации. Поляризация, как и перенапряжение, есть функция плотности тока i. Если при одновременном течении нескольких электродных реакций ток обмена одной реакции значительно выше тока обмена другой, то компромиссный потенциал приближается к равновесному потенциалу более быстрой электродной реакции. [26]
Губчатый осадок оставляет открытой большую часть поверхности MI и смещение компромиссного потенциала в положительную сторону оказывается настолько малым, что металл MI остается в активной области. Электроотрицательный металл MI не пассивируется и в этом случае, когда М2 осаждается оо скоростью, меньшей предельной, я образует плотное покрытие с небольшими порами IB активной области растворения MI. Тогда при некотором соотношении размеров пор и скоростей частных реакций, дальнейшее распространение осадка по поверхности электрода превращается. Рост осадка только в глубь pacmopia оставляет постоянными площади катода и анода, а также потенциал электрода. [27]
При этом у вершины надреза, где прошли пластические деформации, компромиссный потенциал может достигать величины, достаточной для активного растворения анодных участков. Изложенные теоретические представления и экспериментальные данные подтверждают существование и при малоцикловом нагружении коррозионных пар Эванса. На рис. 72 показано влияние коррозионной среды на малоцикловую усталость стали и титановых сплавов. Если степень этого влияния на циклическую долговечность стали и ряда других конструкционных материалов увеличивается со снижением уровня амплитуды напряжений ( с возрастанием длительности пребывания в среде), то для титановых сплавов наблюдается обратная картина: чем ниже амплитуда напряжений, тем меньше влияет среда. При снижении амплитуды напряжений до уровня, при котором в вершине надреза локальные деформации не превышают 2ет ( ет - суммарная деформация, возникающая при напряжении, равном пределу текучести), нарушений защитной оксидной пленки не наблюдается, и долговечность в коррозионной среде приближается к долговечности на воздухе независимо от длительности пребывания сплавов в агрессивных растворах. Таким образом, процесс коррозионных разрушений титановых сплавов при малоцикловом нагружении, как и при статическом нагружении, определяется конкуренцией реакции анодного растворения с процессами репассивации. Если репассивация опережает процесс анодного растворения, возрастание длительности пребывания при максимальной нагрузке в ходе циклического нагруже-ния не приводит к изменению чувствительности к агрессивной среде. Были проведены исследования надрезанных образцов сплава ВТ5 - 1 в 3 % - ном растворе NaCI ( R 0) с изменением выдержки при максимальной нагрузке от 0 05 до 1800 с. [28]
Практически, при цементации меди железом из концентрированных по ионам Си2 растворов компромиссный потенциал быстро стремится к стационарному потенциалу меди в данном электролите и выделение водорода обнаружить не удается. [29]
Если более электроотрицательный компонент сплава менее поляризуем, чем более электроположительный компонент, то компромиссный потенциал приближается по величине к равновесному потенциалу менее поляризуемого электроотрицательного компонента сплава. Наоборот, если более электроположитель - ный компонент сплава менее поляризуем по сравнению с другим компонентом, то величина компромиссного потенциала сплава приближается к равновесному потенциалу более электроположитель, ного компонента сплава. [30]
Страницы: 1 2 3 4