Равновесный потенциал - разряд
Cтраница 1
Равновесный потенциал разряда на графитовом аноде молекул воды с выделением газообразного кислорода ниже равновесного потенциала выделения хлора, и получение практически чистого хлора при электролизе водных растворов хлоридов щелочных металлов становится возможным вследствие большей, по сравнению с хлором, величины перенапряжения кислорода на графите. То же самое происходит и на других применяемых анодных материалах - платине, окислах рутения или магнетите. [1]
Равновесный потенциал разряда на аноде молекул воды с выделением газообразного кислорода ниже равновесного потенциала выделения хлора, поэтому получение практически чистого хлора при электролизе водных растворов хлоридов щелочных металлов становится возможным из-за большего ( по сравнению с хлором) перенапряжения выделения кислорода на применяемых в практике анодных материалах: графите, платине, окислах рутения или магнетите. [2]
Равновесный потенциал разряда па графитовом аноде молекул воды с выделением газообразного кислорода ниже равновесного потенциала выделения хлора, и получение практически чистого хлора при электролизе водных растворов хлоридов щелочных металлов становится возможным вследствие большей, по сравнению с хлором, величины перенапряжения кислорода на графите. То же самое происходит и на других применяемых анодных материалах - платине, окислах рутения или магнетите. [3]
Равновесный потенциал разряда ионов Na на ртути, вследствие образования амальгамы натрия, не превышает 1 8 б и значительно ниже нормального потенциала натрия, равного 2 71 в. Вместе с тем перенапряжение водорода на ртутном электроде очень высоко. Поэтому при больших плотностях тока на катоде будет выделяться металлический натрий, который, растворяясь в ртути, образует амальгаму. [4]
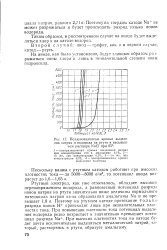
Определим равновесные потенциалы разряда ионов ОН и С1 - на графите. [5]
Однако сопоставление равновесного потенциала разряда ионов цинка с равновесными потенциалами водородного электрода в кислой и щелочной средах ( см. рис. 16) может привести к выводу, что выделение цинка мало вероятно не только в кислой, но и в щелочной среде. Но практика подтверждает возможность осаждения цинка из очень кислых растворов. Возможность электролитического осаждения цинка в нейтральных и кислых растворах определяется значительным перенапряжением выделения водорода на цинке, составляющим около - 0 7 в. [6]
Прежде всего разряжается тот ион, равновесный потенциал разряда которого наиболее положителен. [7]
Теоретически порядок выделения веществ на электродах определяется значением их равновесных потенциалов разряда: сначала разряжается ион, обладающий меньшим потенциалом разряда. [8]
Теоретически порядок выделения веществ на электродах определяется значением их равновесных потенциалов разряда: сначала разряжается ион, обладающий меньшим потенциалом разряда. [9]
Равновесный потенциал выделения кислорода в насыщенном растворе NaCl ниже, чем равновесный потенциал разряда хлора, однако перенапряжение выделения хлора меньше, что видно из табл. 27, в которой указано перенапряжение выделения хлора и кислорода на графите при 25 С. [10]
Ртутный электрод, как уже отмечалось, обладает высоким перенапряжением водорода, а равновесный потенциал разряда ионов натрия на ртути значительно ниже величины нормального потенциала натрия из-за образования амальгамы Na и не превышает 1 8 в. Поэтому на ртутном катоде протекание только разряда ионов Н происходит лишь при незначительных плотностях тока. При высоких плотностях тока на катоде будет почти исключительно выделяться металлический натрий, который, растворяясь в ртути, образует амальгаму. [12]
Ртутный электрод обладает высоким перенапряжением водорода. Равновесный потенциал разряда ионов натрия на ртути значительно ниже нормального потенциала натрия из-за образования амальгамы. [13]
Аналогичная картина наблюдается и в части анодного процесса. Равновесный потенциал свинца настолько отрицательнее равновесного потенциала разряда молекул воды ( ФигО / о, - Ь 1 23 в), что выделения кислорода на свинцовом аноде ожидать не приходится. Большая величина кислородного перенапряжения на свинце создает еще более благоприятные условия для высокого анодного выхода по току металла. [14]
По соотношению этих потенциалов на аноде должен идти в первую очередь разряд ионов ОН - с выделением кислорода. Выделению хлора способствует повышение концентрации NaCl в исходном растворе вследствие уменьшения при этом величины равновесного потенциала разряда СГ. [15]
Страницы: 1 2