Равновесный потенциал - цинк
Cтраница 1
Равновесные потенциалы цинка и олова в растворах их простых солей отличаются в значительной степени, поэтому электроосаждение ведется из растворов комплексных соединений. [1]
Поскольку равновесный потенциал цинка отрицательнее равновесного потенциала водорода, восстановление цинка возможно только вследствие высокого перенапряжения восстановления ионов водорода на цинке. При этом на восстановление водорода расходуется сравнительно небольшое количество электричества, и восстановление цинка становится практически выгодным. [2]
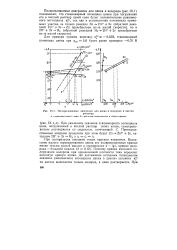
Как видно из рис. 21, стационарный потенциал пластины цинка окажется поло-жительнее равновесного потенциала цинка. [3]
Как видно из рис. 21, стационарный потенциал пластины цинка окажется поло-жительнее равновесного потенциала цинка. Легко заметить, однако, что баланса количеств разряжающихся и ионизирующихся ионов цинка и водорода при этом не будет, так как сумма скоростей ( токов) катодных реакций выделения цинка и водорода ( отрезок ос) будет компенсироваться практически лишь скоростью одной анодной реакции окисления цинка ( отрезок ос), поскольку скорость второй анодной реакции Н2 - 2е - 2Н при этом потенциале ( значительно удаленном в электроотрицательную сторону от равновесного водородного) ничтожно мала и ее можно не учитывать. [4]
 |
Соотношение потенциалов железа, олова и. [5] |
По этой же причине крышки элементов покрывают оловом, так как на никеле или железе при отрицательном равновесном потенциале цинка в щелочном электролите наблюдается выделение водорода из воды. [6]
Реакция образования ионов, едущая за счет передачи зарядов ионам водорода, имеет значительно большую скорость, чем скорость разряда ионов водорода, поэтому равенство / KH aZn достигается при компромиссном потенциале, лежащем очень близко к равновесному потенциалу цинка. [7]
Так обстоит дело, например, при катодном восстановлении цинка из водных растворов его соли. Поскольку равновесный потенциал цинка отрицательнее равновесного потенциала водорода, восстановление цинка возможно только вследствие высокого перенапряжения восстановления ионов водорода на цинке. При этом на восстановление водорода расходуется сравнительно небольшое количество электричества, и восстановление цинка становится практически выгодным. [8]
Из этих ионов менее диссоциированными являются комплексные ионы меди. Благодаря этому концентрация ионов меди при содержании в растворе определенного количества NaCN достигает такой величины, при которой равновесный потенциал медного электрода значительно приближается к равновесному потенциалу цинка. Кроме того образование при этом сплава, при совместном осаждении Си и Zn, деполяризует выделение цинка. [9]
Иногда высокое перенапряжение, наоборот, бывает полезно, уменьшая количество электричества, которое расходуется на ненужное восстановление водорода, сопутствующее основной реакции. Так обстоит дело, например, при катодном восстановлении цинка из водных растворов его соли. Поскольку равновесный потенциал цинка отрицательнее равновесного потенциала водорода, восстановление цинка возможно только вследствие высокого перенапряжения восстановления ионов водорода на цинке. При этом на восстановление водорода расходуется сравнительно небольшое количество электричества, и восстановление цинка становится практически выгодным. [10]
При поляризации внешним током картина изменяется. До достижения значения равновесного потенциала цинка в данных условиях на катоде выделяется только водород, а цинк растворяется. При катодной поляризации электрода водород образуется уже за счет двух процессов: самопроизвольного растворения цинка ( процесс 2Н 2е - - Н2 является сопряженным с процессом Zn - - Zn2 2e) и внешнего катодного тока. [11]
 |
Поляризационная диаграмма для цинка и водорода в кислом. [12] |
До достижения катодным потенциалом значения равновесного потенциала цинка в данных условиях ezn на катоде выделяется только водород, а цинк растворяется. [13]
Следует различать коррозию идеально чистого металла и технического металла. Для идеально чистого металла скорость коррозии определяется перенапряжением и скоростью выделения водорода на этом же металле. Например, для чистого цинка, погруженного в раствор кислоты, стационарный потенциал почти совпадает с равновесным потенциалом цинка и значительно ( более 0 5 в) отличается от равновесного потенциала водорода. [14]
Особое внимание обращается на меры снижения коррозии цинка. Образующийся при коррозии цинка водород заполняет объем, значительно превышающий изменение объема при разряде, и вызывает нежелательное повышение давления в элементе. С целью предотвращения накопления большого количества водорода для изготовления отрицательного электрода используется цинк, содержащий возможно меньшее количество примесей металлов с малым перенапряжением выделения водорода. По этой же причине крышки элементов покрываются оловом, так как на никеле или железе при достаточно отрицательном равновесном потенциале цинка ( - 1 22 в) в щелочном электролите наблюдается выделение водорода из воды. В связи с этим особо жесткие требования предъявляются к характеру гальванического покрытия. Слой олова на крышках не должен иметь пор, по которым электролит мог бы соприкасаться с материалом крышки. Для снижения коррозии цинк отрицательного электрода амальгамируют, а электролит насыщают окисью цинка. В таком растворе коррозия цинка сведена к минимуму. Тем не менее все-таки небольшое количество водорода образуется. [15]
Страницы: 1