Обратимый кислородный потенциал
Cтраница 1
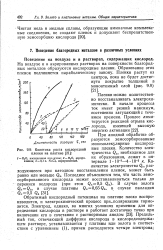 |
Кинетика роста кислородной пленки на платине. [1] |
Обратимый кислородный потенциал на платине плохо воспроизводится, и электрохимический процесс при поляризации тормо зится. [2]
В водной среде обратимый кислородный потенциал трудно реализуется из-за малого тока обмена и образования нестабильного промежуточного продукта реакции - перокснда водорода, который разлагается химически с выделением кислорода. [3]
Под высокими анодными потенциалами здесь подразумевается область потенциалов, превышающих значение обратимого кислородного потенциала. Адсорбционные явления при этих потенциалах носят явно выраженный необратимый характер, что делает невозможным использование рассмотренных выше термодинамических соотношений. Прямые радиохимические измерения адсорбции ионов при высоких анодных потенциалах проведены путем определения радиоактивности после извлечения электрода из раствора и промывки. [4]
Из теоретических положений, высказываемых Донкером и Денгом2 следует, что все кривые должны иметь начало в одной точке, именно - от обратимого кислородного потенциала. Это предположение нельзя проверить непосредственно опытом, ибо если плотность тока упадет ниже некоторого значения ( защитная плотность тока), то на катоде образуются местные анодные площадки и появляется заметная коррозия, причем кривая становится горизонтальной ( значение горизонтальной части кривых обсуждалось на стр. [5]
Заметное анодное выделение кислорода ( i 10 - 6 а-см 2) происходит только при весьма больших перенапряжениях, порядка 0 3 - 0 4 в. Подобные наблюдения были сделаны для большого числа металлов рядом исследователей З 164 406 - 41 которые часто измеряли только наименьшее перенапряжение при начинающемся видимом образовании пузырьков. Такое большое перенапряжение обусловливает трудность установления обратимого кислородного потенциала. Зависимость потенциала от плотности тока отвечает тафелевскому уравнению. Это соотношение для широкого интервала плотностей тока установили еще Вестхауер 14 на платине, иридии и родии и Бенневитц 233, но подробно исследовали только Боуден 15 и Хор 368 для платины. Хотя перенапряжение кислорода было предметом детальных исследований, механизм реакций все еще не выяснен. [6]
Коррозионное поведение железа в крепких щелочах до сих пор не вполне выяснено. Согласно этой диаграмме, область интересующих нас концентраций электролита ( рН10) от обратимого кислородного потенциала почти до обратимого водородного потенциала должна быть областью пассивности железа. В этой области, где серебряные ДСК-электроды работают как кислородные диффузионные электроды, железо покрыто защитной окисной пленкой. Для рН11 5 возле обратимого водородного потенциала существует небольшая агрессивная область, в которой железо разрушается с образованием ферритов. Для электролита с рН 14 эта область охватывает потенциалы от 0 1 до - 0 2 в по отношению к обратимому водородному потенциалу в данном растворе. Однако применение диаграммы Пурбэ для практических коррозионных процессов невозможно без оговорок, так как на равновесие влияют растворенные в воде соли, а это влияние еще не вполне ясно. [7]
Хрупкость Ag-Al - еплавов можно значительно повысить добавками. Ag - - А1 - Cu-сплава легко дробятся и размалываются в шаровой мельнице. КОН медь не переходит в раствор. КОН после окончания активации без нагрузки при подаче кислорода, то происходит заметное растворение меди. Сначала устанавливается стационарный потенциал порядка - 450 мв по отношению к обратимому кислородному потенциалу. [8]
Хрупкость Ag-Al - еплавов можно значительно повысить добавками. Ag - - А1 - Cu-сплава легко дробятся и размалываются в шаровой мельнице. КОН медь не переходит в раствор. КОН после окончания активации без нагрузки при подаче кислорода, то происходит заметное растворение меди. Сначала устанавливается стационарный потенциал порядка - 450 мв по отношению к обратимому кислородному потенциалу. Но через короткое время стационарный потенциал начинает смещаться в положительную сторону, приближаясь к значению около - 200 мв по отношению к обратимому кислородному потенциалу. Одновременно медь переходит в раствор, придавая электролиту интенсивно голубую окраску. На примере электрода № 132 видно, что каталитическая активность исследованных Ag - А1 - Си-сплавов неудовлетворительна. [9]
Страницы: 1