Стандартный электродный потенциал - медь
Cтраница 1
Стандартный электродный потенциал меди равен 0cu / cu 0 34 В и Ф u / Cu 0 52 В. [1]
Стандартный электродный потенциал меди равен 0 34 В, а водорода принят равным нулю. [2]
В соответствии со стандартным электродным потенциалом меди она не должна вытеснять водород из растворов кислот. Объясните, почему медь растворяется в концентрированной хлороводородной кислоте и в растворе сероводорода. [3]
В соответствии со стандартным электродным потенциалом меди она не должна вытеснять водород из растворов кислот. [4]
В соответствии со стандартным электродным потенциалом меди она не должна вытеснять водород из растворов кислот. Объясните, почему медь растворяется в концентрированной хлороводородной кислоте, в растворах сероводорода и хлорида железа FeClv Напишите уравнения реакций. [5]
Почему так сильно отличаются значения стандартных электродных потенциалов меди и цинка, хотя в таблице периодической системы элементы Си и Zn расположены рядом. [6]
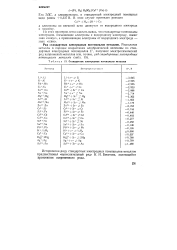 |
Стандартные электродные потенциалы металлов. [7] |
Его ЭДС, а следовательно, и стандартный электродный потенциал меди равны 0 337 В. [8]
В водном растворе СцС1г находятся Си и С1 - - ионы, а также молекулы воды. При пропускании электрического тока начинается движение ионов: Си2 1 - к катоду, Ct - - к аноду. Поскольку стандартный электродный потенциал меди более положителен, чем потенциал водорода ( см. табл. 11), то на катоде восстанавливаются Си - ионы и выделяется медь. На аноде окисляются Cl - ионы и выделяется газообразный хлор. [9]
Как известно, медь менее химически активна, чем водород, и поэтому никак не может вытеснять водород из растворов кислот. Справедливым на 100 % оно станет в том случае, если слово раствор предворить эпитетом водный. Да, в водном растворе стандартный электродный потенциал меди превышает потенциал водорода. А приведенная реакция взаимодействия меди с HCI идет в ацетонитриле, в растворах которого стандартный электродный потенциал меди равен - 0 28 по отношению к водороду. [10]
Как известно, медь менее химически активна, чем водород, и поэтому никак не может вытеснять водород из растворов кислот. Справедливым на 100 % оно станет в том случае, если слово раствор предворить эпитетом водный. Да, в водном растворе стандартный электродный потенциал меди превышает потенциал водорода. А приведенная реакция взаимодействия меди с HCI идет в ацетонитриле, в растворах которого стандартный электродный потенциал меди равен - 0 28 по отношению к водороду. [11]
Страницы: 1