Химический потенциал - соль
Cтраница 1
Химический потенциал соли i является изопиестической парциальной величиной, и вывод о возможности пяти типов граничного хода изопиестических парциальных величин в трех-компонентном растворе ( см. табл. 1.2) приложим и к химическому потенциалу соли i. [1]
Сопоставляя химические потенциалы солей в двойных системах ( рис. 3 - 6), наталкиваемся на аналогичную картину. Объяснение этому может быть дано на основании соображений, высказанных при обсуждении поведения химических потенциалов воды соответствующих систем. [2]
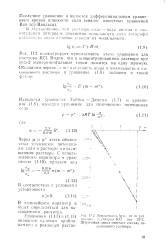 |
Зависимость fa r от т для ч, водных растворов КС. при 25СС ЮГСЯ Паевым прноли - Штриховая линия отвечает составу на - сыщенного раствора. [3] |
Через и и ц здесь обозначены химические потенциалы соли в растворе и в насыщенном растворе. [4]
Уже отмечалось, что в бинарных и многокомпонентных растворах химический потенциал насыщающей соли и ее активность равна определенным, постоянным при данной температуре, значениям. Очевидно, что в системах, не подчиняющихся правилу Здановского ( см. разд. Микулина и другие не могут дать правильной информации. [5]
Напомним, что величина га есть произвольно выбранная моляльность раствора соль i - вода, а ( j 01 ( / n) - химический потенциал соли i в этом растворе. [6]
Химический потенциал соли i является изопиестической парциальной величиной, и вывод о возможности пяти типов граничного хода изопиестических парциальных величин в трех-компонентном растворе ( см. табл. 1.2) приложим и к химическому потенциалу соли i. [7]
Но величина cs должна отвечать среднему значению химического потенциала растворенного вещества внутри мембраны и, следовательно, представлять собой концентрацию гипотетического свободного раствора, находящегося в равновесии с тем участком мембраны, в котором химический потенциал соли имеет среднее значение по мембране. [8]
Последнее уравнение к химическому потенциалу неприменимо, поскольку в (1.22) и (1.12) дифференцируются разные экстенсивные свойства. Поэтому химический потенциал соли i в изопиестических условиях обозначаем без черты. Не применяем также черту над / -, / oi и /, поскольку изопиестическая парциальная водность, как мы видели, имеет смысл только в изопиестических условиях. [9]
В насыщенном растворе какой-либо соли, содержащем избыток растворяемого вещества, существует равновесие между твердой солью и ее раствором. Химический потенциал твердой соли должен быть равен химическому потенциалу соли в насыщенном растворе. Но при некоторой определенной температуре химический потенциал чистых веществ ( в данном случае твердой соли) представляет постоянную величину. Постоянную же величину представляет, следовательно, и химический потенциал соли в насыщенном растворе. Поскольку химический потенциал выражается через активность, то и активность твердей соли и соли в насыщенном растворе должна быть постоянной величиной. [10]
В насыщенном растворе какой-либо соли, содержащем избыток растворяемого вещества, существует равновесие между твердой солью и ее раствором. Химический потенциал твердой соли должен быть равен химическому потенциалу соли в насыщенном растворе. Но при некоторой определенной температуре химический потенциал чистых веществ ( в данном случае твердой соли) представляет, следовательно, и химический потенциал соли в насыщенном растворе. Поскольку химический потенциал выражается через активность, то и активность твердой соли и соли в насыщенном растворе должна быть постоянной величиной. [11]
В насыщенном растворе какой-либо соли, содержащем избыток растворяемого вещества, существует равновесие между твердой солью и ее раствором. Химический потенциал твердой соли должен быть равен химическому потенциалу соли в насыщенном растворе. Но при некоторой определенной температуре химический потенциал чистых веществ ( в данном случае твердой соли) представляет постоянную величину. Постоянную же величину представляет, следовательно, и химический потенциал соли в насыщенном растворе. Поскольку химический потенциал выражается через активность, то и активность твердой соли и соли в насыщенном растворе должна быть постоянной величиной. [12]
В насыщенном растворе какой-либо соли, содержащем избыток растворяемого вещества, существует равновесие между твердой солью и ее раствором. Химический потенциал твердой соли должен быть равен химическому потенциалу соли в насыщенном растворе. Но при некоторой определенной температуре химический потенциал чистых веществ ( в данном случае твердой соли) представляет, следовательно, и химический потенциал соли в насыщенном растворе. Поскольку химический потенциал выражается через активность, то и активность твердой соли и соли в насыщенном растворе должна быть постоянной величиной. [13]
В насыщенном растворе какой-либо соли, содержащем избыток растворяемого вещества, существует равновесие между твердой солью и ее раствором. Химический потенциал твердой соли должен быть равен химическому потенциалу соли в насыщенном растворе. Но при некоторой определенной температуре химический потенциал чистых веществ ( в данном случае твердой соли) представляет постоянную величину. Постоянную же величину представляет, следовательно, и химический потенциал соли в насыщенном растворе. Поскольку химический потенциал выражается через активность, то и активность твердей соли и соли в насыщенном растворе должна быть постоянной величиной. [14]
В насыщенном растворе какой-либо соли, содержащем избыток растворяемого вещества, существует равновесие между твердой солью и ее раствором. Химический потенциал твердой соли должен быть равен химическому потенциалу соли в насыщенном растворе. Но при некоторой определенной температуре химический потенциал чистых веществ ( в данном случае твердой соли) представляет постоянную величину. Постоянную же величину представляет, следовательно, и химический потенциал соли в насыщенном растворе. Поскольку химический потенциал выражается через активность, то и активность твердой соли и соли в насыщенном растворе должна быть постоянной величиной. [15]
Страницы: 1