Изобарно-изотермный потенциал
Cтраница 2
В условиях термодинамического равновесия для анализа развития физико-химических реакций следует определить изобарно-изотермный потенциал Гиббса. Существует ряд методов расчета этого потенциала ( Темки-на - Шварцмана, Владимирова и др.), отличающихся по точности, простоте и универсальности. Для экспертной инженерной оценки вполне применим метод Улиха, опирающийся на наличие большого количества справочных данных о термодинамических свойствах различных веществ: теплоемкости, энтальпии, энтропии. [16]
Для химической реакции dA означает работу химических сил, определяемую убылью изобарно-изотермного потенциала. [17]
Различают четыре характеристических функции: внутреннюю энергию, энтальпию, свободную энергию и изобарно-изотермный потенциал. [18]
В правую часть выражения ( 144) входят только функции состояния, поэтому изобарно-изотермный потенциал также является функцией состояния, а его дифференциал, определяемый выражением ( 147), является полным дифференциалом. [19]
Различают четыре характеристических функции: внутреннюю энергию, энтальпию, свободную энергию и изобарно-изотермный потенциал. [20]
В правую часть выражения ( 144) входят только функции состояния, поэтому изобарно-изотермный потенциал также является функцией состояния, а его дифференциал, определяемый выражением ( 147), является полным дифференциалом. [21]
В литературе встречаются также следующие названия и обозначения термодинамических функ ( изобарный потенциал, изобарно-изотермный потенциал, свободная энергия ГииОса) - С. [22]
В системах р, Т const могут протекать только процессы, ведущие к уменьшению ее изобарно-изотермного потенциала, за счет которого и совершается работа немеханического характера. Это состояние достигается в момент, когда изобарно-изотермный потенциал становится минимальным. [23]
Однако химические потенциалы для условий V, Т const определяются через свободную энергию, а для условий р, Т const - через изобарно-изотермный потенциал. [24]
Работа А максимальна для обратимых процессов и будет всегда меньше при протекании необратимых процессов. Максимальная работа определяется разностью значений изобарно-изотермного потенциала, являющегося функцией состояния. Поэтому эта работа сама является функцией состояния. [25]
В системах р, Т const могут протекать только процессы, ведущие к уменьшению ее изобарно-изотермного потенциала, за счет которого и совершается работа немеханического характера. Это состояние достигается в момент, когда изобарно-изотермный потенциал становится минимальным. [26]
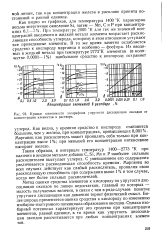 |
Кривые зависимости логарифмов упругости диссоциации оксидов от концентрации элементов в растворе. [27] |
Метод оценки сродства элементов к кислороду по упругости диссоциации оксидов не лишен недостатков, главный из которых - малость получаемых величин, в связи с чем в ряде случаев понятие упругости диссоциации как давления теряет физический смысл. Более широко применяется оценка сродства к кислороду по изменению изобарно-изотермного потенциала образования оксидов. Однако изобарный потенциал характеризует это сродство при концентрации элементов, равной единице, в то время как упругость диссоциации оксидов рассчитывается при любых концентрациях элементов. [28]
При некотором перегреве ( до t) или переохлаждении ( до / 2) наряду со стабильными фазовыми равновесиями вследствие задержки нонвариантных превращений становятся возможными метастабильные фазовые равновесия. И стабильные, и метаста-бильные равновесия характеризуются общими касательными к кривым изобарно-изотермного потенциала. Имеющиеся при этом равновесия представлены в табл. 7, в которой приведены равновесные фазы, а в скобках указывается литер точки, символизирующий состав данной фазы. [29]
Условие равновесия ( 193) гетерогенной системы справедливо для обеих систем: и, Т const и р, Т const. Однако для первой химические потенциалы должны определяться через свободную энергию, а для второй - через изобарно-изотермные потенциалы. [30]
Страницы: 1 2