Замерзание - разбавленный раствор
Cтраница 1
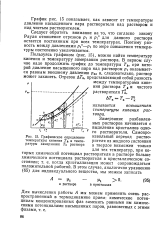 |
Графическое определение температуры кипения Ть и температуры замерзания Тз раствора. [1] |
Замерзание разбавленных растворов начинается с выделения кристаллов одно-т го растворителя. [2]
Точка замерзания разбавленного раствора каучука в бензоле неизмеримо мало отличается от температуры замерзания чистого бензола, однако для очень низкомолекулярных каучуков Кемп и Петере [29] применяли криоскопический метод. Исследованные вещества получались фракционированием натурального каучука и полиизобутилена, деструктированных нагреванием. Вещества, полученные из натурального каучука, содержали значительное количество кислорода, и поэтому их поведение в растворе может несколько отличаться от поведения фракций того же молекулярного веса, полученных из чистого каучукового углеводорода. Кемп и Петере нашли, что в / с не зависит от с только для фракций низшего молекулярного веса, но что вообще кажущийся молекулярный вес зависит от концентрации с. Некоторые из полученных ими результатов для более высокомолекулярных фракций изображены на рис. 7, где с - концентрация, выраженная в граммах на 100 г растворителя, а К-криоскопическая константа для растворителя. [3]
При замерзании разбавленного раствора какой-либо соли, например хлористого натрия, сначала происходит кристаллизация чистого растворителя. [4]
Понижение температуры замерзания разбавленных растворов пропорционально концентрации растворенного вещества. Это заключение можно получить, повторив все рассуждения и математические операции, выполненные при выводе зависимости повышения температуры кипения раствора от концентрации. [6]
Измерение температур замерзания разбавленных растворов HF [4, 6, 25] также подтверждает, что при повышении концентрации растворов наблюдается усиление кислотных свойств HF, как это соответствует приведенной схеме. [7]
Итак, понижение температуры замерзания разбавленного раствора, как и повышение температуры кипения его, пропорционально концентрации растворенного вещества. Это утверждение также впервые было высказано Раулем и называется вторым законом Рауля. [8]
Это уравнение показывает зависимость температуры замерзания разбавленного раствора от состава и изменение растворимости растворителя с ростом температуры. [9]
Опытным путем установлено, что понижение температуры замерзания разбавленного раствора пропорционально концентрации растворенного вещества. В 1883 г. французский химик Ф. М. Рауль сделал очень интересное открытие: понижение температуры замерзания, вызываемое разными растворенными веществами, взятыми в одинаковых молярных количествах, одинаково для данного растворителя. [10]
Опытным путем установлено, что понижение температуры замерзания разбавленного раствора пропорционально концентрации растворенного вещества. В 1883 г. французский химик Ф. М. Рауль сделал очень интересное открытие: понижение температуры замерзания, вызываемое различными растворенными веществами, взятыми в одинаковых молярных количествах, оказывается одним и тем же для данного растворителя. [11]
Опытным путем установлено, что понижение точки замерзания разбавленного раствора пропорционально концентрации растворенного вещества. В 1883 г, французский химик Ф. М. Рауль сделал очень интересное открытие: понижение точки замерзания, вызываемое различными растворенными веществами, взятыми в одинаковых мольных количествах, одинаково для данного растворителя. [12]
В основе криоскопических измерений лежит определение понижения температуры замерзания разбавленного раствора ( АГ3) по сравнению с чистым растворителем. [13]
Это уравнение, выведенное Ф. Н. Шредером, дает зависимость температуры замерзания разбавленного раствора от состава, а также выражает изменение растворимости растворителя с температурой. [14]
Это уравнение, выведенное Ф. Н. Шредером, дает зависимость температуры замерзания разбавленного раствора от состава, а также выражает изменение растворимости растворителя при изменении температуры. [15]
Страницы: 1 2 3
