Замерзание - чистая вода
Cтраница 1
Замерзание чистой воды уже было рассмотрено в § 2 этой главы. Однако в практическом отношении интерес представляет главным образом замерзание природных вод, которые всегда представляют собой растворы электролитов, хотя и разбавленные. Кроме того, в готовых строительных сооружениях или изделиях, в грунтах и тем более в твердеющих вяжущих материалах значительная часть воды находится в связанном состоянии, когда условия замерзания ее могут существенно отличаться от обычных. [1]
Этот процесс отличается от замерзания чистой воды прежде всего тем, что в общем случае кристаллизация воды происходит не при постоянной температуре, а в некотором интервале температур. Как было показано при рассмотрении диаграмм состояния водно-солевых систем ( § 4), этот интервал тем более значителен, чем больше состав раствора отличается от состава криогидрата. Он может достигать нескольких десятков градусов. Лишь для раствора, совпадающего по составу с криогидратом, он обращается в температурную точку. [2]
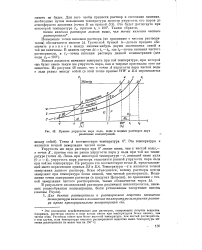 |
Кривые упругости пара льда, воды и водных растворов двух. [3] |
Эта температура и является точкой замерзания чистой воды. [4]
Температура замерзания рассола всегда ниже температуры замерзания чистой воды и зависит от концентрации растворенных солей. [5]
Прежде всего приступают к определению точки замерзания чистой воды. Включают мотор, связанный с мешалкой, или помешивают рукой воду в пробирке со скоростью около одного раза в секунду. [6]
Определив точно в градусах шкалы термометра Бекмана точку замерзания чистой воды, приступают к определению молекулярного веса мочевины. [7]
Перпендикуляр, опущенный на ось абсцисс, отмечает температуру замерзания чистой воды, равную Tz. В точке В значения упругости пара, льда и раствора равны. Следовательно, раствор замерзает при более низкой температуре, чем чистый растворитель. Точка А соответствует упругости пара воды, равной атмосферному давлению. Поэтому Т3 представляет собой температуру кипения воды. Следовательно, раствор кипит при более высокой температуре, чем чистый растворитель. [8]
Замерзание органических растворов в продуктах протекает при более пониженных температурах, чем замерзание чистой воды и сопровождается выделением в твердокристаллическое состояние чистого растворителя - воды. При этом увеличивается концентрация оставшегося раствора. Этот процесс продолжается до тех пор, пока раствор не достигнет эвтектической концентрации, при которой он замерзает без отделения растворителя при температуре ts, называемой эвтектической. [9]
Следовательно, каждой концентрации отвечает определенное понижение точки замерзания раствора сравнительно с точкой замерзания чистой воды. [10]
 |
Охлаждение и осушка воздуха растворами солей в / - d - диаграмме. [11] |
Следовательно, каждой концентрации отвечает определенное понижение точки замерзания раствора сравнительно с точкой замерзания чистой воды. [12]
В работе по криометрии самой высокой температурой, которую приходится измерять, является температура замерзания чистой воды, так как темпера - f II туры замерзания растворов находятся ниже ее. [13]
Исследование этого аддукта показало, что кристаллы льда имеют более рыхлое ( более ажурное) строение, чем в случае льда, получаемого при замерзании чистой воды. В аддукте каждый атом ксенона ( гостя) со всех сторон окружен большим числом молекул Н2О ( хозяина) и как бы попадает в клетку. Подобная картина характерна для всех клатратов ( лат. [14]
Механизм положительной электризации при температурах выше - 10 С заключается в срывании пленки жидкой воды, что находится в согласии с представлениями Ворк-мена и Рейнольдса [584] о разделении зарядов при замерзании чистой воды. [15]
Страницы: 1 2 3