Электрофильный заместитель
Cтраница 2
Для фенолов с электрофильными заместителями ( с относительно высокими / ГдисО / если исследуется распределение их в воду, необходимо учитывать диссоциацию молекул в водной фазе. [16]
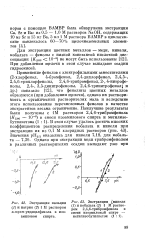 |
Экстракция кальция.| Экстракция [ никеля ( 1 и кобальта ( 2 1 М раствором 2 4 6-трибромфенола в смеси изоамиловый спирт - метилизобутплкетон ( 1. 1. [17] |
Применение фенолов с электрофильными заместителями ( 2-хлорфенол, 4-бромфенол, 2 4-дихлорфенол, 2 4 5 -, 2 4 6-трихлорфенолы, 2 4 6-трибромфенол, 2 -, 4-нитрофе-нолы, 2 4 -, 3 5-динитрофенолы, 2 4 6-тринитрофенол ] и др.) показало [12], что феноляты цветных металлов образуются ( при добавлении щелочи), однако их растворимость в органических растворителях мала и вследствие этого использование перечисленных фенолов в качестве экстрагентов весьма ограниченно. [18]
Сульфонная группа является электрофильным заместителем, что проявляется в отчетливо выраженных кислотных свойствах триметилентрисульфона, образующего нейтральные соли со щелочными металлами. [19]
Следуя этому принципу, электрофильные заместители, которые увеличивают положительный заряд на адсорбционном центре, должны облегчать адсорбцию молекул на отрицательно заряженной поверхности и снижать коррозию, однако они ее увеличивают. Эту аномалию авторы объясняют особенностями выделения водорода на цинке. Поскольку перенапряжение водорода на цинке в отличие от железа велико и скорость его выделения определяется стадией замедленного разряда ионов гидроксония, то при наличии в растворе поверхностно-активных веществ, содержащих атомы с неподеленными - парами электронов, возникают протонизиро-ванные комплексы, которые разряжаются легче, чем ионы гидроксония. Предполагают, что по мере перехода от заместителей с а0 к заместителям с сг0 константа скорости разряда таких комплексов возрастает. [20]
Таким образом, введением электрофильных заместителей - фосфориль-ного и метансульфонильного - к атому азота в амидофосфатах удалось добиться смещения таутомерного равновесия и, таким образом, впервые доказать таутомерию этого типа веществ. Интересные данные были получены при реакции диэтил - К-диэтилфосфориламидофосфата с диазометаном. [21]
Эти заместители облегчают введение следующего электрофильного заместителя в ароматическое кольцо и направляют его в орто - или пара-положение. Например, толуол нитруется легче, чем бензол. [22]
В какие преимущественно положения вступает электрофильный заместитель при взаимодействии: 1) 3-метилфурана и ацетилнитрата, 2) 3-нитротиофена и ацетилхлорида, 3) 3-грег-бутилтиофена и ацетилхло-рида. [23]
Интересно отметить, что как электрофильный заместитель диа-зокатионная группа одна из самых сильных. [24]
В какие положения преимущественно вступает электрофильный заместитель при взаимодействии: а) 3-метилфурана и ацетилнитрата, б) 3-бромтиофена и хлористого ацетила, в) З - тугег-бутилтиофен а и хлористого ацетила. [25]
Объясняется это тем, что электрофильные заместители, оттягивая к себе электроны, уменьшают электронную плотность на электрохимически активной группе ( центре нуклеофильной атаки электрона) и тем самым облегчают присоединение к ней электронов от элек-тродау а нуклеофильные заместители, повышая электронную плотность на активной группе, обусловливают противоположный эффект. Это эмпирическое правило было подтверждено многочисленными исследованиями и до сих пор остается полезным для приближенной оценки влияния заместителей на ЕЧ, электровосстановления. [26]
Объясняется это тем, что электрофильные заместители, оттягивая к себе электроны, уменьшают электронную плотность на электррхими-чески активной группе ( центре нуклеофильной атаки электрона) и тем самым облегчают присоединение к ней электронов от элек-трода а нуклеофильные заместители, повышая электронную плотность на активной группе, обусловливают противоположный эффект. Это эмпирическое правило было подтверждено многочисленными исследованиями и до сих пор остается полезным для приближенной оценки влияния заместителей на Еу, электровосстановления. [27]
В отличие от пиррола действие электрофильных заместителей в к о-лекуле индола направлено в р1 -, а не в - положение. По-видимому, в этом случае образуется энергетически более выгодный а-комплекс с локализацией положительного заряда в - положении к атому азота. [28]
В отличие от пиррола действие электрофильных заместителей в о-лекуле индола направлено в ( 3 -, а не в а-положение. По-видимому, в этом случае образуется энергетически более выгодный а-комплекс с локализацией положительного заряда в а-положении к атому азота. [29]
При наличии у этиленовой связи двух электрофильных заместителей галоген не присоединяется10 п или реагирует в очень жестких условиях. Так, выг - динитроолефины12 взаимодействуют лишь с жидким хлором при длительном стоянии на солнечном свету. [30]
Страницы: 1 2 3 4