Замыкание - шестичленный цикл
Cтраница 1
Замыкание шестичленного цикла в результате образования водородной связи и стабилизации этой связи резонансом повышает устойчивость энола и увеличивает его содержание в равновесной смеси таутомеров. [1]
Возможность замыкания шестичленного цикла в присутствии Pt / C подтверждена далее на примерах 2 5-диме-тилгексана и н-октана, которые превращаются в соответствующие арены с тем же числом атомов углерода в молекуле, что и исходные алканы. [2]
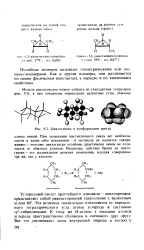 |
Циклогексан в конформации кресла. [3] |
При замыкании шестичленного цикла нет необходимости в каких-либо искажениях - в молекулу не вносится напряжение, - поэтому циклогексан устойчив, практически ничем не отличается от обычных алканов. [4]
Нитрометановый метод замыкания шестичленного цикла был с успехом использован для окончательного установления строения и синтеза стрептидиновой части молекулы стрептомицина. [5]
 |
Схема импульсной микрокаталитической установки. [6] |
Процесс ароматизации алканов включает реакции дегидрогенизации и замыкания шестичленного цикла. Однако изучение соотношения выходов ароматики из алканов, алкенов и цикланов [3] показало, что это маловероятно. [7]
Если в цепи больше пяти атомов углерода, происходит замыкание шестичленного цикла. [8]
Если ароматическое соединение содержит оксогруппу в положении, удобном для замыкания шестичленного цикла, то обработка кислотой приводит к внутримолекулярному гидрокс-и-алкилированию с последующей дегидратацией. Аналогично циклизу-ются ( арилалкил) кетоны и - альдегиды. [9]
Парафиновые углеводороды, содержащие в молекуле достаточное количество углеродных атомов для замыкания шестичленного цикла, в результате дегидроциклизации образуют ароматические углеводороды, которые вследствие своей высокой реакционной способности находят обширное применение в органической химической промышленности. [10]
Далее во времени протекает таутомерное перемещение протона, связанного с атомом азота, к образовавшемуся иону кислорода и замыкание шестичленных циклов водородными связями. [11]
Стоит отметить в этих первых наших работах [253] синтез бмс-тетра-гидроинденилжелеза ацилированием ферроцена янтарным ангидридом, восстановлением по Клемменсену, замыканием шестичленного цикла по Фриделю - Крафтсу и новым восстановлением. Вещество было идентично с полученным Фишером из тетрагидроиндена. Затем нами были подобным образом из фталевого ангидрида и ферроцена получены ферро-ценовые аналоги антрена и антрехинона. [12]
Страницы: 1