Va-подгруппа
Cтраница 1
Элементы VA-подгруппы: азот N, фосфор Р, мышьяк As, сурьма Sb и висмут Bi - сильнее различаются по свойствам, чем элементы других групп. [1]
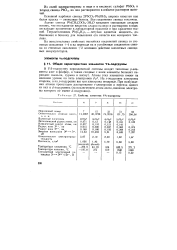 |
Свойства элементов VA-подгруппы. [2] |
В VA-подгруппу периодической системы входят типичные р-эле-менты азот и фосфор, а также сходные с ними элементы больших периодов: мышьяк, сурьма и висмут. На s - подуровне электроны спарены, а на / 7-подуровне все три электрона непарные. [3]
Все элементы VA-подгруппы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или Н3ЭО4, которые обладают кислотными свойствами. Кроме того, для них характерны оксиды типов Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3; у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы амфотерны, а у висмута проявляют основной характер. [4]
 |
Физические свойства сурьмы и висмута. [5] |
Находящиеся в VA-подгруппе периодической системы сурьма и висмут, так же как и гермл нй, являются промежуточными элементами. На наружном уровне оболочек атомы сурьмы и висмута содержат по два s - электрона и по три р-электрона, причем последние являются непарными. Так же, как и германий, сурьма и висмут не способны к образованию элементарных как положительно, так и отрицательно заряженных ионов. [6]
В 3 - м же периоде между металлом алюминием и членом VA-подгруппы неметаллом - фосфором стоит всего лишь кремний. Этот элемент электродный аналог углерода, но радиус Si вдвое больше, а по потенциалу ионизации он близок не к углероду и не к соседям по периоду, а к бору. Однако по отношению к атомам и группам с большим зарядом ядра и малым объемом координационное число кремния равно шести. Для кремния, как и других членов 3-го периода, правило октета строго не выполняется и довольно часто нарушается. Использование р-орби-талей при образовании кратных я-связей в 3 - м периоде менее важно, чем для их аналогов из 2-го периода. К созданию таких связей они могут привлекать d - орбитали, только в таком случае число электронных пар на внешнем уровне может быть более четырех. Кремний, как и последующие элементы 3-го периода, в соединениях имеет я-связи за счет участия свободных 3 -орбиталей. [7]
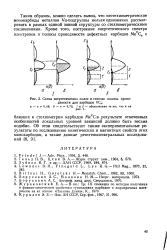 |
Схема энергетических полос и генезис полосы проводимости для карбидов VC. [8] |
Таким образом, можно сделать вывод, что нестехиометрические монокарбиды металлов Va-подгруппы нельзя однозначно рассматривать в рамках единой зонной структуры со стехиометрическими соединениями. [9]
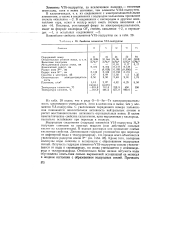 |
Свойства элементов VIA-подгруппы. [10] |
Из табл. 28 видно, что в ряду О-S - Se-Те электроотрицательность закономерно уменьшается, хотя в целом она и выше, чем у элементов VA-подгруппы. С увеличением порядкового номера халькогенов понижается окислительная активность нейтральных атомов и растет восстановительная активность отрицательных ионов. В целом неметаллические свойства халькогенов, ярко выраженные у кислорода, несколько ослабевают при переходе к теллуру. [11]
Напротив, для Bi ( гягнодгруппа) подобные соединения достоверно не установлены [ Ахметов. Va-подгруппы ( см. табл. 1) отвечает и систематике по признаку сходства свойств солей кислородных кислот этих элементов. [12]
Однако в таком состоянии простых ионов они не образуют. По сравнению с VA-подгруппой усиливается их комплексообразующая способность. Окислительно-восстановительный потенциал элементов подгруппы кислорода положительнее водорода и уменьшается от кислорода к полонию. Поэтому Se, Те и Ро не вытесняют водород из растворов и получают их электролизом водных растворов соединений, содержащих простые ионы. С водородом они образуют соединения с полярной ковалентной связью со смещением электронных пар от водорода к элементу. Однако уже соединение Ir Te является неустойчивым эндотермическим соединением. У полония и в меньшей степени у теллура про являются свойства образовывать катионы. [13]
Известно, что чем меньше радиус атома, тем ярче выражена электроотрицательность химического элемента. Следовательно, из элементов VA-подгруппы азот - наиболее электроотрицательный и наиболее сильный окислитель. Окислительная способность элементов падает от азота к висмуту, а восстановительные свойства их усиливаются в том же направлении. [14]
Сопоставление таких солей кислородных кислот показывает, что нитраты резко отличаются от подобных веществ Va-эле-ментов. Это вполне соответствует самостоятельному положению N ( Уа-подгуппа) среди элементов Va-подгруппы. [15]
Страницы: 1 2