Наблюдаемая валентность
Cтраница 1
 |
Взаимодействие атомов водорода ( а, атомов водорода с атомом азота ( б и валентная схема молекулы МН3 ( в. [1] |
Наблюдаемые валентности в общем согласуются с ожидаемыми, за исключением двух случаев - бериллия и углерода. Известно, что углерод имеет валентность 4, тогда как в. Чтобы объяснить валентность 4, мы должны были бы предположить, что атом углерода находится в состоянии с четырьмя свободными электронами. Такое состояние действительно существует. Оно возникает при переходе одного из 2з - электронов на свободный 2рг - уровень. [2]
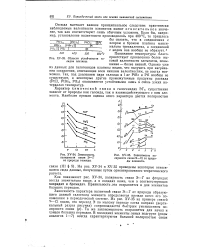 |
ЗЗ. Области устойчивости га-лидов платины.| Зависимость полярности связи Э - С1 от природы элемента. [3] |
Отсюда вытекает важное принципиальное следствие: практически наблюдаемые валентности элементов имеют относительное значение, так как соответствуют лишь обычным условиям. [4]
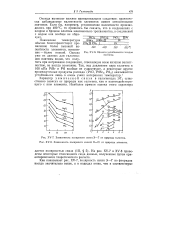 |
Области устойчивости галидов платины.| Зависимость полярности связи Э - - Г от природы галогена. [ IMAGE ] - 8. Зависимость полярности связей Э - С1 от природы элемента. [5] |
Отсюда вытекает важное принципиальное следствие: практически наблюдаемые валентности элементов имеют относительное значение. Если бы, например, установление валентности производилось при 400 С, то пришлось бы сказать, что в соединениях с хлором и бромом платина максимально трехвалентна, а соединений с иодом она вообще не образует. [6]
Из приведенных данных вытекает важное принципиальное следствие: практически наблюдаемые валентности элементов имеют относительное значение, так как соответствуют лишь обычным условиям. Если бы, например, установление валентности производилось при 400 С, то пришлось бы сказать, что в соединениях с хлором и бромом платина максимально трехвалентна, а соединений с иодом она вообще не образует. [7]
Из таблицы видно, что для водорода, лития, азота, кисло-рода и фтора наблюдаемые валентности соответствуют числу неспаренных электронов. У атома гелия и неона, не содержа щих неспаренных электронов, валентность равна нулю. В остальных случаях валентности могут иметь значения боль-ше числа неспаренных электронов. [8]
По-видимому, в какой-то степени так же, как для серы и хлора объясняются переменные валентности, можно объяснить возможность образования химических связей и наблюдаемые валентности у ксенона. По сравнению с атомами гелия и неона, где на внешних оболочках нет неспаренных электронов и вакантных орбиталей, у ксенона имеются вакантные орбитали и, следовательно, появляется возможность возбуждения ( рас-спаривания) электронов на эти орбитали. В настоящее время соединения ксенона с такими валентностями получены. [9]
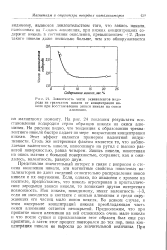 |
Зависимость числа эквивалентов водорода на грамматом никеля от концентрации никеля при восстановлении закиси никеля на окиси алюминия. [10] |
На рис. 24 показаны результаты восстановления водородом серии образцов никеля на окиси алюминия. На рисунке видно, что тенденция к образованию трехвалентного никеля быстро падает по мере возрастания концентрации никеля. Этот эффект является примером валентной индуктивности. Столь же интересным фактом является то, что наблюдаемая валентность никеля, нанесенного на рутил с высоко развитой поверхностью, равна четырем. Закись никеля, нанесенная на окись магния с большой поверхностью, сохраняет, как и ожидалось, валентность, равную двум. [11]
Страницы: 1