Наивысшая валентность
Cтраница 1
Наивысшая валентность элемента совпадает с номером его группы в периодической системе и равняется общему числу имеющихся в атоме непарных ( непрочно спаренных) электронов. Максимальная валентность элементов обычно наблюдается в кислородных соединениях ( окислах) и фторидах. Практически, в частности как промышленные яды, большое значение имеют разновалентные окислы металлов, а также их гидроокислы. [1]
Следовательно, наивысшая валентность элементов каждой группы, за некоторыми исключениями, совпадает с номером группы. Кроме того, группу характеризует валентность по водороду. Элементы I, II и III групп - металлы; они или совсем не образуют соединений с водородом, или образуют малоустойчивые соединения. Металлоиды IV, V, VI и VII групп при нормальных условиях образуют с водородом газообразные соединения. Типы этих соединений также приведены в таблице. [2]
Браунер доказал, что наивысшая валентность церия равна четырем. [3]
Металлы в металлорганических соединениях проявляют обычно наивысшую валентность, которая им свойственна, причем могут образовывать как чисто металлорганические соединения, в которых все валентности металла затрачены на соединение с углеродом, так и смешанные металл-органические соединения, в которых часть валентностей затрачена на соединение с углеродом, а другая часть на соединение с атомами других элементов. [4]
Металлы в металлорганических соединениях проявляют обычно наивысшую валентность, которая им свойственна, причем могут образовывать как чисто Металлорганические соединения, в которых все валентности металла затрачены на соединение с углеродом, так и смешанные Металлорганические соединения, в которых часть валентностей затрачена на соединение с углеродом, а другая часть на соединение с атомами других элементов. [5]
Сверху ( римской цифрой) обозначается наивысшая валентность элемента по кислороду в окисле; численно она равна номеру группы элементов в системе Менделеева; снизу стоят атомные веса. При переходе же от хлора с атомным весом 35 5 к аргону с атомным весом 39 9 валентность внезапно падает до нуля с тем, чтобы в следующем периоде вновь начать возрастать. [6]
Для элементов главных подгрупп периодической системы существует правило: наивысшая валентность каждого элемента совпадает с номером группы, в которой он находится. [7]
Для элементов главных подгрупп периодической системы существует правило: наивысшая валентность каждого элемента совпадает с номером группы, в которой он находится. Водород отклоняется от общего правила ввиду того, что ему не отведено особого места в периодической системе, а помещают его в главную подгруппу VII группы периодической системы. В качестве элемента с зарядом ядра 1 водород может отщеплять только один электрон и выступать в качестве положительно одновалентного. [8]
Для элементов главных подгрупп периодической системы существует правило: наивысшая валентность каждого элемента совпадает с номером группы, в которой он находится. Водород отклоняется от общего правила ввиду того, что ему не отведено особого места в периодической системе, а помещают его в главную подгруппу VII группы периодической системы. В качестве элемента с зарядом ядра 1 водород может отщеплять только-один электрон и выступать в качестве положительно одновалентного. [9]
В той же мере, в какой элементы могут быть электроположительными, они проявляют свою наивысшую валентность по отношению к кислороду. Кроме того, в соединениях с кислородом они могут проявлять также и низшие валентности. [10]
Какова плотность по водороду паров летучего соединения урана с фтором, в котором уран проявляет наивысшую валентность. [11]
 |
Важнейшие типы соединений в главных подгруппах периодической системы. [12] |
В той же мере, в какой элементы могут быть электроположительными, они проявляют свою наивысшую валентность по отношению к кислороду. Кроме того, в соединениях с кислородом они могут проявлять также и низшие валентности. [13]
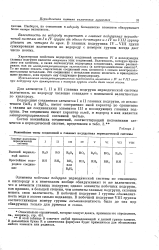 |
Важнейшие типы соединений в главных подгруппах периодической системы. [14] |
Для элементов I, II и III главных подгрупп периодической системы валентность по водороду численно совпадает с наивысшей валентностью по кислороду. [15]
Страницы: 1 2