Более высокая валентность
Cтраница 1
Примеси более высокой валентности, чем атомы решетки-матрицы, не всегда требуют компенсации заряда в непосредственной близости. [1]
Ионы с более высокой валентностью адсорбируются значительно лучше одновалентных. [2]
Ионы с более высокой валентностью адсорбируются значи -, тельно лучше одновалентных. [3]
Ряд элементов проявляют более высокую валентность, чем в простых соединениях, например галогены проявляют валентность, равную трем, азот - пяти. [4]
Чтобы литий проявил более высокую валентность, надо перевести один электрон из 1 s - в 2 р-состояние. [5]
Ионы актинидов с более высокой валентностью изучены в соединениях, в основном отличных от тех, которые характерны для 4 / - группы. В двух группах наиболее важных из этих соединений ионы актинидов расположены в узлах решетки с симметрией правильного октаэдра. В газовой фазе структура молекул UF6, NpF6 и PuF6 такова, что атом металла находится в центре правильного октаэдра, образованного шестью атомами фтора, которые отстоят от атома металла на расстояниях 0 1996, 0 1981 и 0 1971 нм соответственно. Некоторые из четырехвалентных ионов были исследованы в соединениях Cs2ZrCle и [ ( CH3) 4N ] 2PtCl6, в каждом из которых ион металла окружен правильным октаэдром из ионов хлора. [6]
Присутствие в растворе ионов более высокой валентности приводит к дальнейшему усложнению теории термодинамических свойств растворов, даже в случае растворителей с большой диэлектрической постоянной. [7]
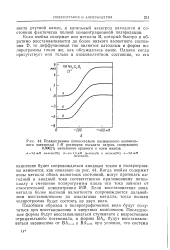 |
Подпрограммы ( относительно насыщенного каломельного электрода 1 М растворов оксалата натрия, содержащих 0 0002 % метилового красного и ионы железа. [8] |
Если восстановление иона металла более высокой валентности сопровождается дальнейшим восстановлением до амальгамы металла, тогда полная аолярограмма будет состоять из двух волн. [9]
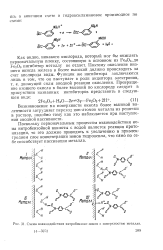 |
Схема взаимодействия нитробензоат-ионов с поверхностью металла. 14 5972 209. [10] |
Возникновение на поверхности окисла более высокой валентности затрудняет переход ион-атомов металла из решетки в раствор, подобно тому как это наблюдается при наступлении анодной пассивности. [11]
Дифференциал Ли для тензоров более высокой валентности вычисляется по тому же правилу для каждого индекса в отдельности, в зависимости от того, будет ли этот индекс ковариантным или контравариантным. [12]
Дифференциал Ли для тензоров более высокой валентности вычисляется по тому же правилу для каждого индекса в отдельности, в зависимости от того, будет ли этот индекс ковариантным или контрава-риантным. [13]
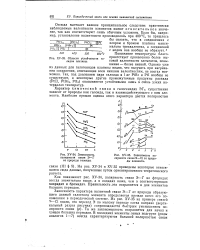 |
ЗЗ. Области устойчивости га-лидов платины.| Зависимость полярности связи Э - С1 от природы элемента. [14] |
Понижение температуры благоприятствует проявлению более высокой валентности элементов повышение - более низкой. Однако уже из данных для галогенидов платины видно, что получить при нагревании соединения, отвечающие всем низшим валентностям, не всегда возможно. Так, под давлением пара галоида в 1 ат PtBr и PtI вообще не существуют, а некоторые другие промежуточные продукты распада ( PtCl, PtBr2 PtI3) оказываются устойчивыми лишь в очень узких интервалах температур. [15]
Страницы: 1 2 3 4