Via-подгруппа
Cтраница 1
Элементы VIA-подгруппы - это кислород, сера, селен, теллур и радиоактивный металл полоний. [1]
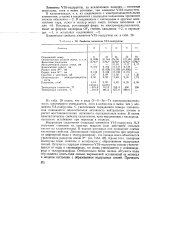 |
Свойства элементов VIA-подгруппы. [2] |
Элементы VIA-подгруппы, за исключением полония - типичные неметаллы, хотя и менее активные, чем элементы VIIA-подгруппы. [3]
Все элементы VIA-подгруппы, за исключением полония, встречаются в природе как в свободном виде, так и виде соединений. [4]
Так, например, в VIA-подгруппе кислород - окислитель, сера проявляет слабые окислительные свойства, а теллур в некоторых реакциях уже является восстановителем. Это объясняется возрастанием сверху вниз числа энергетических уровней атомов, их радиус становится больше и, следовательно, внешние электроны слабее удерживаются. Действительно, у атомов кислорода всего два энергетических уровня и радиус атома равен 0 066 нм, а у атомов теллура 5 уровней и радиус атома больше - он равен 0 137 нм. [5]
Си, Ag, Аи; Па-подгруппа цинка Zn, Cd, Hg; Ilia-подгруппа скандия Sc, Y, La, Ac; IVa-подгруппа титана Ti, Zr, Hf, Th; Va - подгруппа ванадия V, Nb, Та, Ра; Via-подгруппа хрома Cr, Mo, W; Vila - подгруппа марганца Mn, Ma, Re. VIII группа составлена тремя триадами: Fe, Co, Ni; Ru, Rh, Pd и Os, Ir, Pt; 4) наконец в системе имеем еще 14 металлов редких земель. [6]
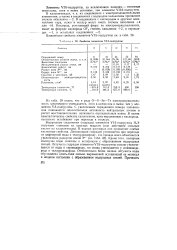 |
Свойства элементов VIA-подгруппы. [7] |
В водных растворах они проявляют слабые кислотные свойства. Летучесть гидридов элементов VIA-подгруппы сильно увеличивается от воды к сероводороду, но снова уменьшается у селеноводо-рода и теллуроводорода. Относительно более низкая летучесть воды обусловлена опять-таки сильно выраженной ассоциацией ее молекул в жидком состоянии с образованием водородных связей. [8]
Геометрия молекулы - это взаимное пространственное расположение ее атомов, которое определяется длинами связей и валентными углами. Представления метода валентных связей позволяют объяснить геометрию многих молекул. Например, элементы VIA-подгруппы в основном состоянии имеют по два неспаренных р-электрона. [9]
Страницы: 1