Vib-группа
Cтраница 2
В степени окисления 4 характеристические соединения существуют для всех трех элементов VIB-группы. Диоксиды хрома и его аналогов нерастворимы в воде, трудно растворимы в кислотах и щелочах. Отвечающие им гидроксиды не известны. В то же время высокотемпературным синтезом могут быть получены некоторые соли, в которых элементы VIB-группы в степени окисления 4 образуют оксоанионы. Отсюда следует, что в степени окисления 4 оксиды хрома и его аналогов проявляют скорее слабо выраженные кислотные, чем основные функции. Вообще же степень окисления 4 ярче проявляется у галогенидов и халькогенидов. [16]
В степени окисления 4 характеристические соединения существуют для всех трех элементов VIB-группы. Диоксиды хрома и его аналогов нерастворимы в воде, трудно растворимы в кислотах и щелочах. Отвечающие им гидроксиды неизвестны. [17]
В степени окисления 4 характеристические соединения существуют для всех трех элементов VIB-группы. Диоксиды хрома и его аналогов нерастворимы в воде, трудно, растворимы в кислотах и щелочах. Отвечающие им гидроксиды неизвестны. [18]
Координаты 4VIB в Периодической системе означают 4 - й период и VIB-группу, элемент хром; 4VIIIB2 - 4 - й период, УП1Б2 - группу, элемент никель; 61Б - 6 - й период, IB-группа, элемент золото; 6ПБ - 6 - й период, ПБ-группа, элемент ртуть. [19]
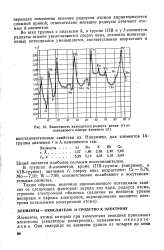 |
Зависимость кажущегося радиуса атома ( г от порядкового номера элемента ( Z. [20] |
В группах d - элементов, кроме IIIB-группы ( например, в VIB-группе), значения 1 сверху вниз возрастают: Сг - 6 76; Мо - 7 10; W - 7 99, соответственно ослабевают и восстановительные свойства. [21]
В своих соединениях проявляет степень окисления от 2 до 6 и обнаруживает двойную аналогию: с актинием и с металлами VIB-группы. Ураи, как и хром, реагирует с растворами H2S04 и HC1 с выделением водорода. [22]
Температуры плавления металлов в периодах системы Д. И. Менделеева сначала возрастают, начиная с простых веществ металлов IA-группы, и достигают максимума у простых веществ металлов VIB-группы, где находится самый тугоплавкий металл - вольфрам. [23]
Характерными для переходных металлов вообще и для элементов VIB-группы в частности являются фазы внедрения. Наибольшее количество фаз внедрения элементы VIB-группы образуют с бором, причем разнообразие соединений уменьшается в ряду Сг-Mo - W. Последние три борида представляют собой полисоединения, в которых внедренные атомы бора образуют кластеры в пустотах кристаллической решетки. Такое разнообразие боридов обусловлено особенностями бора, который склонен к образованию цепей и каркасов. [24]
Характерными для переходных металлов вообще и для элементов VIB-группы в частности являются фазы внедрения. Наибольшее число фаз внедрения элементов VIB-группы образуют с бором, причем разнообразие соединений уменьшается в ряду Сг - Mo - W. Последние три борида представляют собой полисоединения, в которых внедренные атомы бора образуют кластеры в пустотах кристаллической решетки. Такое разнообразие боридов обусловлено особенностями бора, который склонен к образованию цепей и каркасов. [25]
Характерными для переходных металлов вообще и для элементов VIB-группы в частности являются фазы внедрения. Наибольшее число фаз внедрения элементов VIB-группы образуют с бором, причем разнообразие соединений уменьшается в ряду Сг - Mo - W. Так, в системе Сг - В зарегистрировано существование восьми соединений: Cr4B, Cr3B, Cr2B, Сг5В2, CrB, СгзВ4, СгВ2, СгВв - Последние три борида представляют собой полисоединения, в которых внедренные атомы бора образуют кластеры в пустотах кристаллической решетки. Такое разнообразие боридов обусловлено особенностями бора, который склонен к образованию цепей и каркасов. [26]
Наибольшее количество промежуточных фаз типа соединений Курнакова образуется при взаимодействии элементов подгруппы хрома с триадой железа и платиновыми металлами ( CrFe, CrNi, CrCo. При этом состав соединений Курнакова никогда не обогащен элементом VIB-группы. Поскольку соединения Курнакова образуются из твердых растворов ( непрерывных или ограниченных), можно сделать вывод, что элементы VIB-группы значительно лучше растворимы в металлах VIIIB-группы, чем последние в хроме и его аналогах. [27]
В) и реагирует с большинством элементов Периодической системы. В своих соединениях он проявляет степени окисления от 2 до 6 и обнаруживает двойную аналогию: с актинием и металлами VIB-группы. Уран, как и хром, реагирует с растворами H2S04 и НС1 с выделением водорода. При 150 С уран быстро окисляется с образованием оксидов переменного состава. Области гомогенности фаз на основе этих оксидов уменьшаются с увеличением относительного содержания кислорода. Наиболее характерными являются оксиды UO2 и UOg. Последний с водой дает ряд гидратов, важнейшими из которых являются диурановая H2U2Or и урановая H2U04 кислоты. Их соли - уранаты - известны для активных металлов. Соли уранила более характерны, чем уранаты, а последние сильно гидролизованы в растворах. [28]
Однако твердость их различна и, как и тугоплавкость, обусловливается прочностью пространственной кристаллической решетки. Наиболее твердые - простые вещества металлов VIB-группы; так, хром по твердости приближается к алмазу. [29]
Наибольшее количество промежуточных фаз типа соединений Курнакова образуется при взаимодействии элементов подгруппы хрома с триадой железа и платиновыми металлами ( CrFe, CrNi, CrCo. При этом состав соединений Курнакова никогда не обогащен элементом VIB-группы. Поскольку соединения Курнакова образуются из твердых растворов ( непрерывных или ограниченных), можно сделать вывод, что элементы VIB-группы значительно лучше растворимы в металлах VIIIB-группы, чем последние в хроме и его аналогах. [30]
Страницы: 1 2 3