Запись - химическая реакция
Cтраница 1
Запись химической реакции, совпровождаемую указанием теплового эффекта, принято называть термохимическим уравнением. [1]
Запись химических реакций посредством химических формул, соединенных знаком плюс и знаком равенства, называется уравнением химической реакции. [2]
Запись химических реакций посредством химических формул, соединенных знаком плюс и знаком равенства, называется химическим уравнением реакции. [3]
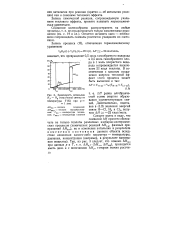 |
Зависимость энтальпии НТ - Н0 ( ккал / моль свинца от. [4] |
Запись химической реакции, сопровождаемую указанием теплового эффекта, принято называть термохимическим уравнением. [5]
Запись химической реакции посредством химических знаков, формул исходных и полученных веществ, а также математических знаков называют химическим уравнением, которое определяет количественные соотношения между реагентами и продуктами реакции. Химическое уравнение обозначает, что суммарные массы и энергии вступивших в реакцию веществ всегда равны суммарной массе и энергии образовавшихся продуктов реакции. [6]
Запись химической реакции посредством химических формул называют химическим уравнением. Составление химических уравнений основано на использовании основных законов химии, в том числе закона сохранения массы веществ при химической реакции и закона постоянства состава. [7]
Для записи химических реакций в аналитической химии используют молекулярные, ионные и ионно-электронные уравнения. При составлении уравнений и проведении расчетов рекомендуется использовать следующие положения. [8]
Для записи химических реакций каждый элемент обозначается определенным символом из латинских букв. [9]
Наш способ записи химических реакций легко распространить на сложные процессы с несколькими одновременно протекающими реакциями. Пусть S веществ вступают в R реакций. [10]
Благодаря такой стенографии запись химических реакций сильно упростилась. [11]
Наиболее рациональным способом является естественная запись химических реакций: номер реакции, символьное выражение, тепловой эффект. [12]
Важным частным случаем общей формы записи реакций в виде ( 1) является запись химических реакций через базис. Если у нас есть совокупность независимых реакций ( 1), то линейными преобразованиями - суммированием реакций и умножением их коэффициентов на числа - ее можно преобразовать так, чтобы в матрице стехиометрических коэффициентов а. Те вещества, коэффициенты при которых не относятся к указанному блоку, образуют базис. [13]
Относятся к состоянию вещества ( соответственно-газ, жидкость, твердое тело) при записи химической реакции. [14]
Эта система отвечает хорошо известному правилу составления уравнений химических реакций: число атомов каждого вида и зарядов слева в обычной записи химической реакции должно равняться числу этих же атомов и зарядов справа. Казалось бы, что при такой процедуре для составления уравнений химических реакций, достаточно простых самих по себе, привлекается слишком серьезный математический аппарат. [15]
Страницы: 1 2 3