Принцип - квантовая механика
Cтраница 1
Принципы квантовой механики требуют, чтобы в этом случае обе структуры участвовали в основном состоянии системы в одинаковой степени. [2]
Ряд принципов квантовой механики является общим для электронного и ядерного спинов. Ниже мы рассмотрим для электронного спина S некоторые из этих положений. [3]
Согласно принципам квантовой механики, на одном разрешенном энергетическом уровне могут находиться один или два электрона. [4]
Согласно принципам квантовой механики электроны в изолированных атомах могут иметь только строго определенные для данных типов атомов значения энергии или, как говорят, находиться только а определенных ( разрешенных) энергетических уровнях. [5]
Согласно принципам квантовой механики, состояние электрона в атоме характеризуется четырьмя так называемыми квантовыми числами: п, I, т и s, где п - главное квантовое число, в основном определяющее энергию электрона; / - орбитальное ( побочное) квантовое число, характеризующее момент количества движения электрона; m - магнитное квантовое число, характеризующее проекцию момента количества движения электрона на некоторое выделенное направление, а именно - направление внешнего магнитного поля; s - спиновое квантовое число, характеризующее некоторый дополнительный момент количества движения электрона, присущий самому электрону. [6]
Согласно принципам квантовой механики, состояние электрона в атоме характеризуется четырьмя так называемыми квантовыми числами: п, I, т и s, где п - главное квантовое число, в основном определяющее энергию электрона; / - орбитальное ( побочное) квантовое число, характеризующее момент количества движения электрона; т-магнитное квантовое число, характеризующее проекцию момента количества движения электрона на некоторое выделенное направление, а именно - - направление внешнего магнитного поля; s - спиновое квантовое число, характеризующее некоторый дополнительный момент количества движения электрона, присущий самому электрону. [7]
Согласно принципам квантовой механики на одном разрешенном энергетическом уровне могут находиться один или два электрона. [8]
Согласно принципам квантовой механики любая атомная система в процессе своего внутреннего движения может находиться только в определенных состояниях, называемых квантовыми. Для характеристики данного квантового состояния в квантовой механике используется так называемая волновая функция, а последовательность различных квантовых состояний характеризуется набором волновых функций, соответствующих этим состояниям. [9]
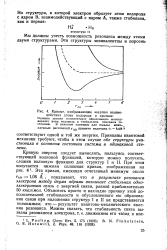
 |
Расщепление энергети - возбужденном состоянии элек-ческих уровней в твердом теле. трОн может находиться в тече. [10] |
Согласно принципам квантовой механики электроны в изолированных атомах могут обладать только строго определенными для данных типов атомов значениями энергии или, как говорят, находиться только на определенных ( разрешенных) энергетических уровнях. [11]
Согласно принципам квантовой механики ( разд. [12]
Согласно принципам квантовой механики, атомы и молекулы устойчивы лишь в нек-рых стационарных состояниях, к-рым отвечают определ. [13]
Согласно принципам квантовой механики, мы можем найти одновременно точные значения двух свойств системы, если только соответствующие операторы коммутируют один с другим ( следствие VII, стр. Возникает вопрос, какие из операторов угловых моментов коммутируют. [14]
Согласно принципам квантовой механики частицы одного сорта ( элементарные частицы, атомы, молекулы) не просто одинаковы по своим свойствам, они совершенно не отличимы друг от друга. Как следствие, два состояния системы, различающиеся только перестановкой частиц по допустимым для них ( одночастичным) состояниям, тоже оказываются не отличимыми одно от другого. Их необходимо принимать за одно состояние системы в целом. Принципиально неверно было бы утверждать, что в системе тождественных частиц частица А имеет набор квантовых чисел а, а частица В - набор ( i. Можно говорить лишь о таком состоянии системы, в котором одна из общего числа частиц имеет состояние а, а другая 6, без всякой конкретизации, к какой из частиц квантовые числа аир относятся. [15]
Страницы: 1 2 3 4