Принцип - смещение - равновесие
Cтраница 3
Тогда согласно принципу смещения равновесия должны возникнуть процессы, способствующие уменьшению объема, занимаемого жидкостью и паром. [31]
Таким образом, принцип смещения равновесия позволяет сознательно управлять обратимым процессом, смещая его в том или ином направлении. [32]
Таким образом, принцип смещения равновесий Ле-Шателье позволяет заранее предсказывать, в какую сторону сместится равновесие при изменении параметров состояния реакции, и наоборот, какое изменение следует внести в условия проведения процесса для увеличения выхода продукта. Однако для количественных нового положения равновесия и теоретического протекания реакции необходимы расчеты с использованием соответствующих уравнений в интегральной форме. [33]
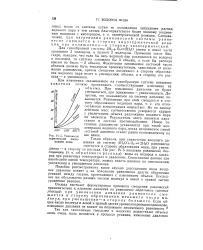 |
Равновесие термической диссоциации воды. [34] |
Отсюда вытекает формулировка принципа смещения равновесий применительно к влиянию давления на равновесие обратимых газовых реакций: при увеличении давления равновесие смещается в сторону образования меньшего числа молекул, при уменьшении - в сторону большего. Если общее число молекул в левой и правой частях уравнения реакции одинаково, изменение давления не влияет на положение химического равновесия. [35]
 |
Равновесие термической диссоциации воды. [36] |
Отсюда вытекает формулировка принципа смещения равновесий применительно к влиянию давления на равновесие обратимых газовых реакций: при увеличении давления равновесие смещается в сторону образования меньшего числа молекул, при уменьшении - в сторону большего. [37]
 |
Равновесие термической диссоциации воды. [38] |
Отсюда вытекает формулировка принципа смещения равновесий применительно к влиянию давления на равновесие обратимых газовых реакций: при увеличении давления равновесие смещается в сторону образования меньшего числа молекул, при уменьшении - в сторону большего. Если общее число молекул в левой и правой частях уравнения реакции одинаково, изменение давления не влияет на положение химического равновесия. [39]
Отсюда вытекает формулировка принципа смещения равновесий применительно к влиянию давления на равновесие обратимых газовых реакций: при увеличении давления равновесие смещается в сторону образования меньшего числа молекул, при уменьшении - в сторону большего. Очевидно, что если общее число молекул в левой и правой частях уравнения реакции одинаково, изменение давления не будет влиять на положение химического равновесия. [40]
Но это противоречит принципу смещения равновесий. [41]
В соответствии с принципом смещения равновесия характер зависимости N от Р определяется знаком величины Vi - Fi, которая, в свою очередь, зависит от свойств чистого компонента, сжимаемости растворителя, природы и концентрации раствора. [42]
В соответствии с принципом смещения равновесий ( принцип Ле-Шателье), если на систему, находящуюся в установившемся динамическом равновесии, воздействуют извне, изменяя одно из условий, определяющих положение равновесия, то в системе усиливается тот процесс, течение которого ослабляет влияние произведенного воздействия. [43]
В соответствии с принципом смещения равновесия характер зависимости Nt от Р определяется знаком величины Vt - Vt, которая в свою очередь зависит от свойств чистого компонента, сжимаемости растворителя, природы и концентрации раствора. [44]
Это правило носит название принципа Смещения равновесия Ле-Шателье - Брауна. [45]
Страницы: 1 2 3 4