Природа - растворенное вещество
Cтраница 3
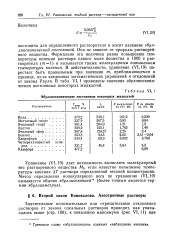 |
Эбуллиоскопические постоянные некоторых жидкостей. [31] |
Она не зависит от природы растворенного вещества. Формально эта величина равна повышению температуры кипения раствора одного моля вещества в 1000 г растворителя ( т 1) и называется также молекулярным повышением температуры кипения. В действительности, уравнение ( VI, 19) перестает быть правильным при значении т, приближающемся к единице, из-за введенных математических упрощений и отклонений от закона Рауля. В табл. VI, 1 приведены значения эбуллиоскопических постоянных некоторых жидкостей. [32]
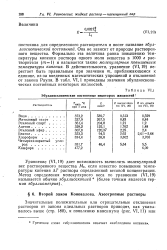 |
Эбуллиоскопические постоянные некоторых жидкостей. [33] |
Она не зависит от природы растворенного вещества. Формально эта величина равна повышению температуры кипения раствора одного моля вещества в 1000 г растворителя ( т) и называется также молекулярным повышением температуры кипения. В действительности, уравнение ( VI, 19) перестает быть правильным при значении т, приближающемся к единице, из-за введенных математических упрощений и отклонений от закона Рауля. В табл. VI, 1 приведены значения эбуллиоскопических постоянных некоторых жидкостей. [34]
Коэффициент К зависит от природы растворенного вещества, природы и количества неподвижной фазы, температуры и скорости потока газа-носителя. [35]
Степень диссоциации зависит от природы растворенного вещества и растворителя, а также от концентрации раствора и температуры. [36]
Кдб не зависит от природы растворенного вещества. В табл. 4 приведены эбулиоскопические постоянные некоторых растворителей, а в табл. 6 - температуры кипения насыщенных растворов некоторых солей. [37]
Величина А зависит от природы растворенного вещества и растворителя, концентрации раствора и давления. [38]
 |
Эбуллиоскопические постоянные некоторых жидкостей. [39] |
Она не зависит от природы растворенного вещества. Формально эта величина равна повышению температуры кипения раствора одного моля вещества в 1000 г растворителя ( / п1) и называется также молекулярным повышением, температуры кипения. В действительности, уравнение ( VI, 19) перестает быть правильным при значении т, приближающемся к единице, из-за введенных математических упрощений и отклонений от закона Рауля. В табл. VI, 1 приведены значения эбуллиоскопических постоянных некоторых жидкостей. [40]
Величина Atx не зависит от природы растворенного вещества. [41]
В зависимости от условий и природы растворенного вещества гидроперекисный радикал может быть окислителем или восстановителем. В реакциях окисления гидроперекисный радикал превращается в Н202, а в реакциях восстановления - в свободный кислород. [42]
P) i зависит от природы растворенного вещества, температуры и давления, но не от концентрации. [43]
В зависимости от условий и природы растворенного вещества гидроперекисный радикал может быть окислителем или восстановителем. В реакциях окисления гидроперекисный радикал превращается в Н202, а в реакциях восстановления - в свободный кислород. [44]
P) i зависит от природы растворенного вещества, температуры и давления, но не от концентрации. Nt представляет собой молярную долю данного вещества в растворе. [45]
Страницы: 1 2 3 4