Природа - ионная связь
Cтраница 1
Природа ионной связи впервые была выяснена Косселем в 1916 г. Несколько ранее представление о способности электронов переходить от одного атома к другому было высказано В. [1]
Природу ионной связи, структуру и свойства ионных соединений объясняют с позиций электростатической теории химической связи. Такой подход является удачным для объяснения образующейся связи в галогенидах щелочных металлов. [2]
Наиболее проста природа ионной связи. Для ее описания не требуется привлечения квантовой механики. Химическая связь обеспечивается за счет электростатического притяжения ионов. [3]
Наиболее проста природа ионной связи. Для ее качественного и количественного описания не требуется привлечения квантовой механики. Ионную связь удовлетворительно описывает теория атома Бора. Первоначально Крссель считал, что при взаимодействии разнородные атомы стремятся приобрести конфигурацию внешней электронной оболочки инертных газов. Это достигается отдачей и присоединением электронов. Атомы, отдающие свои электроны, превращаются в положительно заряженные ионы, а присоединяющие электроны - в отрицательные ионы. Химическая связь обеспечивается за счет электростатического притяжения образовавшихся ионов. [4]
Обычно при обсуждении природы ионной связи принимается, что в идеальном случае ионы являются жесткими, недеформируемыми сферами. Однако ионы решетки находятся в электрическом поле соседних атомов, вследствие чего центр тяжести противоположно заряженных ионов смещается и образуется диполь. [5]
Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул. [6]
Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул. [7]
Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов, а не в виде отдельных молекул. [8]
 |
Логарифмы электропроводности стекол системы SiC2 - NasSiO3 - PbSiOs при температуре 1000. [9] |
Сравнивая изменения вязкости и электропроводности на-триево - свинцово - силикатных стекол, можно заключить, что вязкие свойства расплавов этой системы определяются прочностью структурной связи кремнеземной сетки, в то время как электропроводность их обусловлена в основном природой ионных связей стекла. [10]
Коссель считал, что ионная связь носит только электростатический характер. При объяснении природы ионной связи было отмечено следующее. [11]
В табл. 16.2 указаны энергии отдельных стадий цикла Борна - Габера для некоторых галогенидов щелочных металлов. Близкое соответствие между результатами расчетов, выполненных двумя независимыми методами, лишний раз убеждает нас в том, что мы правильно представляем себе природу ионной связи. [12]
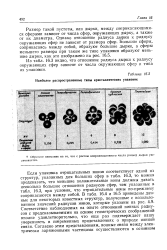 |
Наиболее распространенные типы кристаллических упаковок. [13] |
Если упаковка отрицательных ионов соответствует одной из структур, указанных для больших сфер в табл. 16.3, то можно предсказать, что меньшие положительные ионы должны давать несколько большие отношения радиусов сфер, чем указанные в табл. 16.3, при условии, что отрицательные ионы по-прежнему соприкасаются между собой. В табл. 16.4 и 16.5 приведены данные для некоторых известных структур, полученные с использованием значений радиусов ионов, которые указаны на рис. 4.9. Соответствие наблюдаемых на опыте отношений ионных радиусов с предсказываемыми на основе геометрических соображений вполне удовлетворительно, что еще раз подтверждает нашу уверенность в современных представлениях о природе ионной связи. [14]
Ионные соединения обычно весьма твердые, но хрупкие. Твердость ионных веществ обусловлена невозможностью образования кратных связей вследствие разделения ионов в пространстве и отсутствия теплового движения ионов. Хрупкость объясняется природой ионной связи: даже при относительно небольшом сдвиге ионов возникают контакты анион - анион и катион - катион и вместо сил притяжения появляются силы отталкивания. Вследствие этого кристалл раскалывается, как это часто наблюдается у многих минералов. [15]
Страницы: 1