Природа - центр - адсорбция
Cтраница 1
Природа центров адсорбции в Я-агрегатах, невидимому, еще менее ясна, чем в / - агрегатах. Однако такое влияние рН компенсируется большими концентрациями желатины. В Я-агрегатах, образуемых некоторыми красителями в чисто водных растворах, молекулы, повидимому, ориентированы не столь строго, как в / - агрегатах, однако появление новой полосы поглощения свидетельствует о наличии хотя бы частичной молекулярной связи. [1]
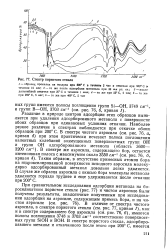 |
Спектр пористого стекла. [2] |
Различие в природе центров адсорбции этих образцов выявляется при удалении адсорбировнного метанола с поверхности обоих образцов при одинаковых условиях откачки. Наиболее резкое различие в спектрах наблюдается при откачке обоих образцов при 200 С. Таким образом, в отсутствие примесных атомов бора на гидроксилированной поверхности исходного аэросила молеку-лярно адсорбированный метанол довольно легко удаляется. В случае же образца аэросила с окисью бора молекулы метанола удаляются гораздо труднее и еще удерживаются после откачки при 200 С. [3]
Главы X и XI посвящены спектральным исследованиям природы центров адсорбции различных катион-ных и декатионированных форм цеолитов и состояния молекул, адсорбированных такими цеолитами. Относящийся к цеолитам материал рассмотрен с целью выявления структурных элементов остова и, в первую очередь, структурных гидроксильных групп и катионных вакансий, ведущих к возникновению различных кислотных центров, и роли этих центров в проявлении адсорбционных и каталитических свойств цеолитов. [4]
Это обстоятельство позволяет сделать некоторые заключения о природе центров адсорбции алюмосиликагеля и бентонита. [5]
Инфзрмация о состоянии катионов переходных металлов ( к.п.м.) на поверхности окисных катализаторов ( зарядовое состояние, степень координационной насыщенности, характер связи с ближайшим окружением) представляется важной для выяснения природы центров адсорбции, их изменений под воздействием реакционной среды и, в конечном счете, для понимания механизмов поверхностных реакций в каталитических процессах. В настоящей работе предлагается метод исследования состояния к.п.м. на поверхности катализаторов с помощью ЙК-спектроскошш адсорбированных молекул СО и МО. [6]
Главы IV-VII посвящены исследованиям химии поверхности кремнеземов и адсорбции кремнеземами. В этих главах обобщен полученный к настоящему времени материал по спектральному исследованию поверхностных химических соединений и механизма адсорбции на гидроксилированной и дегидроксили-рованной поверхности кремнеземов молекул различной геометрической и электронной структуры. Рассматривается природа центров адсорбции на дегидроксилированных в различной степени поверхностях кремнеземов и важная роль примесных центров в молекулярной адсорбции и хемосорбции кремнеземами. [7]
Необходимо расширить число объектов исследования, включив сюда различные окислы, соли, органические кристаллы, пористые полимеры и монослои. Во всех этих случаях химический еостав и состояние поверхностных соединений должны быть предметом тщательного количественного изучения. В частности, исследование такого благоприятного для спектрального изучения объекта, как кремнезем, перспективно проводить в направлении получения количественно сопоставимых с другими адсорб-ниоными исследованиями данных. При этом основное внимание должно быть обращено на спектральное исследование природы центров адсорбции и среди них на изучение центров примесной природы при малых заполнениях поверхности адсорбирующимися молекулами. [8]
Это замечание относится также и к представленному в книге материалу по цеолитам. Исследование цеолитов методом ИК-спек-троскопии началось фактически только в последние 3 - 4 года. В самые последние годы спектральным методом получены не вошедшие в книгу интересные результаты по исследованию природы центров адсорбции катионирован-ных и декатионированных цеолитов. [9]
Если дейтероацетилен реагировал с образцом дейтерирован-ной окиси алюминия, то результаты были аналогичны тем, которые суммированы в табл. 28 по данным предыдущего исследования. Эта полоса поглощения, очевидно, обусловлена насыщенным соединением, содержащим группу CD, и для нее не может быть дано другой интерпретации. Был проделан опыт, в котором после того, как дейтероацетилен адсорбировали на дейтерированной окиси алюминия и удаляли избыточное количество газа откачкой, на образце адсорбировали этилен. Поверхностные этильиые группы образовывались из этилена, содержащегося независимо от хемосорбированного дейтероацетилена. Эти результаты иллюстрируют независимую природу центров адсорбции обоих газов. [10]
Низкотемпературная форма хемосорбции водорода, обнаруженная нами, проявляет удивительное сходство с соответствующей формой хемосорбции кислорода. Действительно, обе эти формы адсорбции требуют энергии активации, обе в одинаковом температурном интервале имеют качественно сходные изотермы, изобары и изостеры адсорбции и тем самым удовлетворяют экспоненциальной неоднородной поверхности. Вероятнее всего в хемосорбции как водорода, так и кислорода принимают участие одни и те же центры поверхности, обладающие избыточной электронной плотностью и способные в случае кислорода полностью перетянуть электрон от Адсорбционного центра. Такими электронно-донорными центрами, вероятно, являются валентно - и координационно-ненасыщенные ионы металла, образующиеся при удалении остаточных гидроксильных и карбонатных групп поверхности. При всей схожести в поведении форм адсорбции кислорода и водорода и природе центров адсорбции трудно объяснить образование на поверхности ионных кристаллов нейтральных молекул водорода без электронного взаимодействия. При этом происходит, вероятно, внутримолекулярный перенос электронной плотности от иона металла к иону кислорода, так что суммарный поверхностный заряд не изменяется. Различие в величинах хемосорбции кислорода и водорода при одинаковых условиях тренировки окислов можно объяснить в рамках электронной теории значительным изменением положения уровня Ферми при хемосорбции кислорода, препятствующим дальнейшей хемосорбции в заряженной форме. Судя по теоретическим расчетам [44], донорная способность катиона должна усиливаться в ряду окислов гольмия, иттрия, лантана. [11]
Таким образом, рассмотренный выше экспериментальный материал показывает, что плавление льда начинается с межфазной границы. Фазовый переход лед-вода имеет точечный характер лишь для идеального бесконечного кристалла. Для кристаллов с большой удельной поверхностью фазовый переход имеет размытый характер, так как заметное количество жидкой фазы наблюдается в некотором интервале температур. Отметим, что в отличии от калориметрических измерений метод ЯМР фиксирует замерзание адсорбированной воды при заполнении в монослой и ниже. В этих случаях, по-видимому, структура замерзшей фазы сильно отличается от структуры гексагонального льда и тесно связана с топографией и природой центров адсорбции. Для таких систем, как и для микропористых адсорбентов, корректнее говорить о переходе в системе адсорбент-адсорбат. [12]
Страницы: 1