Заполнение - орбиталь
Cтраница 1
Заполнение орбиталей электронами осуществляется точно так же, как и в случае гомоядерных молекул. Молекула BN изоэлектронна с С2; различие между ними заключается главным образом в том, что уровни ях v и а, становятся очень близкими и для перевода одного электрона на орби-таль ст, достаточно энергии, выделяемой при распаривании двух электронов с орбитали пху. [2]
 |
Схематическое изображение электронного облака трех р-орбиталей. [3] |
Заполнение орбиталей равной энергии происходит в соответствии с правилом Гунда, согласно которому электроны заполняют эти орбитали возможно более равномерно. Сначала каждую орбиталь занимает один электрон, и только тогда, когда на всех орби-талях уже будет по одному электрону, на них может разместиться второй электрон с противоположным спином. [4]
Рассмотрим заполнение орбиталей в молекуле кислорода. [5]
 |
Конфигурация гипотетического дианиона бензола. [6] |
Порядок заполнения орбиталей в этих двух случаях весьма различается. [7]
Порядок заполнения орбиталей электронами определяется двумя конкурирующими факторами. [8]
 |
Энергия стабилизации кристаллическим полем. [9] |
Способ заполнения орбиталей определяется силой поля лиган-дов. Если поле слабое, величина ЭСКП мала, и третий электрон попадает на 2-орбиталь; при этом возникает конфигурация со свободными спинами. С другой стороны, сильное поле лигандов приводит к спариванию спинов на е-уровне. Приведенные аргументы могут быть распространены на другие конфигурации d - электронов ( d di0), а также на случай плоских квадратных комплексов с координационным числом четыре. [10]
Порядок заполнения орбиталей подуровня определяется правилом Хунда ( табл. 2): I В пределах подуровня электроны заполняют макси - мольное количество орбиталей. [11]
Порядок заполнения орбиталей подуровня подчиняется правилу Хунда: в пределах подуровня электроны заполняют максимальное количество орбиталей. [12]
 |
Распределение электронной плотности в атоме аргона. [13] |
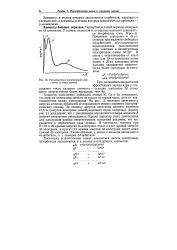
Характер заполнения орбиталей атомов К, Са и Sc показывает, что энергия электронов зависит не только от заряда ядра, но и от взаимодействия между электронами. Анализ рис. 11 показывает, что с увеличением порядкового номера элемента Z энергия электронов уменьшается. Однако характер этого уменьшения для электронов разных энергетических состояний различен, что выражается в пересечении хода кривых. В частности, поэтому при Z19 и 20 кривые энергии 4з - электрона лежат ниже кривой энергии З - электрона, а при Z-21 кривая энергии З - электрона лежит ниже кривой 4р - электрона. Таким образом, у калия и кальция заполняется 45-орбиталь, а у скандия З - орбиталь. [14]
Последовательность заполнения орбиталей атомов, начиная с более низких по энергии, характеризуется тем, что электроны первоначально по одному занимают разные орбитали и имеют параллельные спины. [15]
Страницы: 1 2 3 4
