Заполнение - молекулярный орбиталь
Cтраница 1
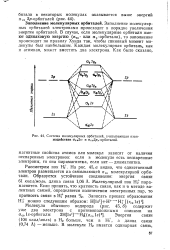 |
Система молекулярных орбиталей, учитывающая взаимодействие 0св2 - и 0Св2ра. - орбиталей. [1] |
Заполнение молекулярных орбиталей электронами происходит в порядке увеличения энергии орбиталей. В случае, если молекулярные орбитали имеют одинаковую энергию ( ясв - или яр-орбитали), то заполнение происходит по правилу Хунда так, чтобы спиновый момент молекулы был наибольшим. Каждая молекулярная орбиталь, как и атомная, может вместить два электрона. [2]
Заполнение молекулярных орбиталей электронами начинается с ф 5 имеющей самое низкое значение собственной энергии ег. [3]
 |
Схема молекулярных орбиталей для молекул, образованных элементами второго периода. [4] |
Заполнение молекулярных орбиталей электронами происходит в порядке увеличения энергии орбиталей. В случае, если молекулярные орбитали имеют одинаковую энергию ( Лев - или Яр-орбитали), то заполнение происходит по правилу Хунда, так, чтобы спиновый момент молекулы был наибольшим. Каждая молекулярная орбиталь, как и атомная, может вместить два электрона. [5]
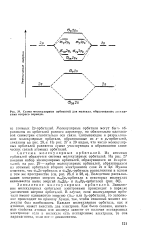 |
Схема молекулярных орбиталей для молекул, образованных элементами второго периода. [6] |
Заполнение молекулярных орбиталей электронами происходит в порядке увеличения энергии орбиталей. В случае, если молекулярные орбп-тали имеют одинаковую энергию ( ясв - или Яр-орбитали), то заполнение происходит по правилу Хунда, так, чтобы спиновый момент молекулы был наибольшим. Каждая молекулярная орбиталь, как и атомная, может вместить два электрона. Как было сказано, магнитные свойства атомов или молекул зависят от наличия неспаренных электронов: если в молекуле есть неспаренные электроны, то она парамагнитна, если нет - диамагнитна. [7]
Восемнадцатиэлектронное заполнение локальных молекулярных орбиталей в этих соединениях достигается при условии, что в связи Fe - Fe участвует лишь одна пара электронов. В молекулах остальных соединений расстояния Fe - Fe значительно короче, но также лежат в широких пределах от 2 40 до 2 64 А. [8]
Последовательность заполнения молекулярных орбиталей электронами определяется, как и в атомах, принципом минимума энергии: сначала заполняется та орбиталь, которой соответствует наиболее низкая энергия, затем - орбитали с большими значениями полной энергии. Максимальное число электронов на любой молекулярной орбитали определяется, как и в атоме, принципом Паули. В соответствии с этим принципом в молекуле водорода оба электрона находятся на связывающей орбитали. Так как нахождение электронов на связывающей орбитали приводит к уменьшению энергии системы, молекула водорода устойчива. [9]
 |
Образование связующих и разрыхляющих молекулярных орбиталей в молекуле кислорода из атомных s - и / з-орби. [10] |
Порядок заполнения молекулярных орбиталей определяется запретом Паули и энергетическими соображениями. Сначала заполняются молекулярные орбитали с более низким уровнем энергии, причем на каждой молекулярной орбитали может находиться не более двух электронов с разными спинами. [11]
 |
Образование кова-лентной связи Н - Н.| Контурная карта электронной плотности связывающей молекулярной орбиталп в На. [12] |
При заполнении вырожденных молекулярных орбиталей каждая из них должна получить по одному электрону, прежде чем любая из них получит два электрона. [13]
 |
Схемы образования МО из s - AO ( а и р - АО ( б. [14] |
Теоретически порядок заполнения молекулярных орбиталей строго - не рассчитан. [15]
Страницы: 1 2 3