Заполнение - подгруппа
Cтраница 1
Заполнение подгрупп электронами по мере увеличения атомного номера элемента идет таким образом, что каждый вновь добавляемый электрон стремится занять самый низкий ( из еще не заполненных) энергетический уровень, так как это соответствует наиболее прочной его связи с ядром. Однако в действительности некоторые уровни [ например, nd и ( п 1) р ] нередко меняются местами. Распределение электронов по подгруппам в атоме каждого элемента видно из данных приводимой ниже таблицы ( стр. [1]
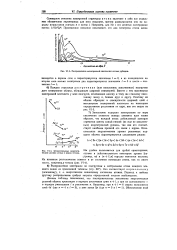 |
Относительные энергети - Им удобно пользоваться для грубой ориентировки, ческие уровни атома и ионов титана. однако в действительности некоторые уровни [ на. [2] |
Заполнение подгрупп электронами по мере увеличения атомного номера элемента идет таким образом, что каждый вновь добавляемый электрон стремится занять самый низкий ( из еще не заполненных) энергетический уровень, так как это соответствует наиболее прочной его связи с ядром. [3]
Заполнение подгрупп по мере увеличения атомного номера элемента идет таким образом, что каждый вновь добавляемый электрон стремится занять самый низкий ( из еще не заполненных) энергетический уровень, так как это соответствует наиболее прочной его связи с ядром. Распределение электронов по подгруппам в каждом атоме видно из данных приводимой таблицы ( стр. [4]
Заполнение подгруппы 4f происходит у элементов от Се до Yb, составляющих группу редкоземельных элементов, называемых лантанидами, которые, благодаря сходству строения внешних электронных оболочек, мало различаются между собой по химическим свойствам. Установлены и другие закономерности в изменении свойств химических элементов. [5]
Заполнение подгрупп электронами по мере увеличения атомного номера элемента идет таким образом, что каждый вновь добавляемый электрон стремится занять самый низкий ( из еще не заполненных) энергетический уровень, так как это соответствует наиболее прочной его связи с ядром. Однако в действительности некоторые уровни [ например, nd к ( п) р ] нередко меняются местами. Распределение электронов по подгруппам в атоме каждого элемента видно из данных приводимой ниже таблицы ( стр. [6]
 |
Эффективность карбидообразования. [7] |
Устойчивость соединения достигается тем, что углерод отдает свои валентные электроны на заполнение подгрупп 3d, 4d или 5d у металла, что обеспечивает у карбидов прочную металлическую связь. Поэтому углерод в карбидах ведет себя как металл, и все карбиды в целом обладают металлическими свойствами. Чем меньше заполнены у металла подгруппы 3d, 4d или 5d, например, при наличии достаточного количества хрома в стали, тем скорее углерод соединится с хромом, чем с железом. [8]
Эти нарушения последовательности заполнения электронами оболочек повторяются и служат причиной образования побочных групп в периодической системе элементов. Заполнение подгруппы 4 / происходит у элементов от Се до 1Ь, составляющих группу редкоземельных элементов, называемых л а и т а н и д а м и, которые благодаря сходству строения внешних электронных оболочек весьма мало различаются между собой по химическим свойствам. У группы элементов, называемых актинидами, наблюдается подобная же достройка 5 / подгруппы, расположенной глубоко внутри атома. [9]
Второй группой редкоземельных элементов являются так называемые актиниды. Все актиниды отличаются заполнением подгруппы 5 /, а внешние их электроны находятся в состоянии, аналогичном состояниям лантанидов. [10]
Показатель степени указывает число электронов, находящихся на энергетическом уровне. Согласно периодической системе Д. И. Менделеева при переходе от одного химического элемента к другому - с большим порядковым номером и большим числом электронов - происходит постепенное заполнение электронной подгруппы, затем заполняется следующая подгруппа той же группы: в новую группу электроны попадают лишь после полной достройки предыдущей. Например, при переходе от аргона ( порядковый номер. То, что четвертая группа начинает заполняться при незаполненной до конца 3d подгруппе, объясняется энергетическими различиями между 4s и Sd-орбитами в атоме. [11]
В атомах элементов, расположенных после кальция ( Sc, Ti, V и др.), имеющих во внешней оболочке по два электрона ( у хрома - один), достраивается незаполненная Ы подгруппа М - оболочки. Эти нарушения последовательности заполнения электронами оболочек повторяются и служат причиной образования побочных групп в периодической системе элементов. Заполнение подгруппы 4 / происходит у элементов от Се до Ib, составляющих группу редкоземельных элементов, называемых лантанидами, которые благодаря сходству строения внешних электронных оболочек, весьма мало различаются между собой по химическим свойствам. Установлены и другие закономерности в изменении свойств химических элементов. [12]
В этом заключается причина того, что их химические свойства аналогичны. В последовательном ряду элементов, расположенных по величине заряда ядра их атомов, по мере усложнения атома и возникновения новых электронных слоев периодически повторяются элементы, атомы которых содержат одинаковое число электронов в наружном слое. Это и является причиной периодичности в свойствах элементов. Усложнения этой периодичности, заключающиеся в образовании побочных подгрупп и своеобразной группы лантаноидов, объясняется, как мы видели, усложнениями в последовательности заполнения различных электронных подгрупп. [13]
Страницы: 1