Заполнение - уровни
Cтраница 1
Заполнение уровней протонами и нейтронами происходит независимо и в соответствии с принципом Паули. На каждом протонном уровне может находиться 2 / - f - 1 протонов, на каждом нейтронном уровне - столько же нейтронов. Вследствие расщепления уровней обусловленного спин-орбитальным взаимодействием, уровни с / I 1 / 2 ПРИ I Э 3 переходят в другую, более низкую оболочку. Непосредственный подсчет числа нуклонов в оболочках, начиная с оболочки lsi / o, дает как раз магич. Первая оболочка содержит только один уровень 1st /, к-рый может быть заполнен двумя протонами или ( и) двумя нейтронами. Вторая оболочка содержит уровни р и / з /, на к-рых может находиться по 6 нуклонов каждого сорта. Ядро с заполненными двумя первыми протонными и нейтронными оболочками содержит но 8 протонов и нейтронов. Третья оболочка заполняется 12 нуклонами, так что соответствующее ядро с тремя замкнутыми оболочками будет содержать 20 нейтронов или ( и) 20 протонов ( напр. Как видно из рис., числа заполнения остальных ядерных оболочек равны 28, 50, 82 и 126 ( что и объясняет магич. При заполнении этих оболочек начинает сказываться роль кулоновских сил отталкивания, к-рые сдвигают уровни протонов в область более высоких энергий. [1]
Заполнение уровней группы завершается s - электронами. После этого происходит переход к следующей ( п /) - группе. [2]
Заполнение уровней анергии проводится в соответствии с Паули принципом. Однако при больших А ( 150) квадрупольные моменты ядер отличаются от значений, предсказываемых оболочечной моделью, в 10 - 100 раз. Поэтому была предложена ротационная модель для несферич. В обобщенной модели сохраняются осн. Активно развиваются кластерные модели, в к-рых используется представление об образовании взаимодействующих между собой кластеров из двух или большего числа нуклонов. Тем не менее ни одна из моделей не может претендовать на последоват. [3]
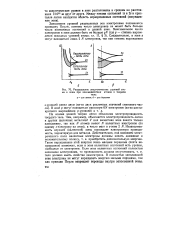 |
Расщепление энергетических уровней атома в зоны при взаимодействии атомов в твердом. [4] |
Заполнение уровней разрешенных зон электронами подчиняется принципу Паули, поэтому число электронов не может быть больше числа возможных состояний в данной зоне. Максимальное число электронов в зоне должно быть не больше qN ( где q - степень вырождения исходных уровней атома; гл. [5]
Заполнение уровней электронных оболочек согласно квантовой механике происходит в соответствии со следующими правилами. [6]
Порядок заполнения уровней электронами регламентируется правилом возбуждения валентностей ( правилом Гунда), согласно которому при заполнении группы уровней, относящихся к данному побочному числу s, р, d или /, например, пяти d - уровней, более низкому энергетическому ( основному) состоянию атома отвечает размещение в каждом из этих уровней сначала одиночных w - электронов ( холостых), и лишь если у атома нехватает, например, с. [7]
Степень заполнения уровней зависит от положения уровня Ферми, которое можно менять соответствующим легированием полупроводника донорными или акцепторными примесями с малой энергией активации. [8]
Отношение чисел заполнения уровней определяется множителем Больцмана: e - g BH kT Хотя показатель экспоненты здесь на три порядка больше, чем для ядерных моментов, при комнатных температурах и обычных полях он все же мал. [9]
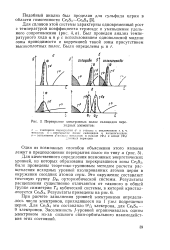 |
Перекрытие электронных полос силицидов переходных элементов. [10] |
При расчете заполнения уровней электронами определялось число электронов, приходящееся на 1 узел подрешетки церия. Для Ce3S4 это составляло 9 / з электрона, для Се25з - 9 электронов. [11]
Как указывалось, заполнение уровней фосфоресценции зависит лишь от экспозиции It, а не от времени или интенсивности возбуждения в отдельности. Ход кривой насыщения дается формулой (3.26) и рис. 200 ( стр. [12]
Подобное ( теоретическое) заполнение уровней можно составить и для атомов последующих элементов. Имеется лишь несколько различий между экспериментальными и теоретическими конфигурациями. Например, ( п - l) d - и ns - подуровни при их заполнении оказываются близко лежащими друг к другу. Если имеет место стабилизация заполненных или полузаполненных подуровней ( см. разд. Однако не следует придавать таким различиям слишком большого значения, их влияние на химию элементов минимально. [13]
Дальнейшие отклонения от порядка заполнения уровней можно проследить по таблице Менделеева. [14]
Вбольших периодахс ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. [15]
Страницы: 1 2 3 4