Ионная проводимость
Cтраница 1
Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относится большинство органических соединений, например, спирты, углеводы. [1]
Ионные проводимости могут быть определены экспериментально из наблюдений над электропроводностью сильно диссоциированных соединений, содер-жящих данные ионы. [2]
Ионная проводимость является характерной для NaCl, электронная - для металлов. В теории ионной и электронной проводимости важная роль отводится дефектам структуры. [4]
Ионная проводимость зависит от напряженности поля вследствие изменения подвижности ионов; эта зависимость становится ощутимой только при напряженностях, близких к пробивным. [5]
 |
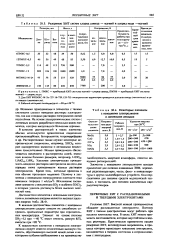
Типичные величины электропроводности Тип проводимости Материалы а, Ом-1 - см-1. [6] |
Ионная проводимость таких материалов часто обусловлена особенностями их кристаллической структуры, а именно наличием туннелей или слоев. Величины проводимости этих материалов сравнимы с аналогичными характеристиками сильных жидких электролитов. В настоящее время большое внимание уделяется изучению свойств твердых электролитов, разработке новых типов этих материалов и расширению областей их применения в твердофазных электрохимических устройствах. [7]
Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. [8]
 |
Резервные ХИТ систем хлорид свинца - магний и хлорид меди - магний.| Некоторые элементы. [9] |
Ионная проводимость обеспечивается введением в растворители солей, имеющих анионы больших размеров, например, иСЮ4, ЫАГСЦ, LSBF4 - Удельная электрическая проводимость неводных растворов электролитов на один-два порядка ниже проводимости водных растворов электролитов. Кроме того, катодные процессы в них обычно протекают медленно. Исключение составляют элементы с окислителем SO2 и особенно SOC12, в которых удалось достигнуть более высоких плотностей тока. [10]
Ионная проводимость - электропроводность, при которой электрический заряд переносится свободными ионами, перемещающимися в веществе под действием электрического поля. Различают собственную и примесную ионную проводимость. [11]
Ионная проводимость Хм при бесконечном разведении равна эквивалентной проводимости электролита при бесконечном разведении, умноженной на число переноса соответствующих ионов при бесконечном разведении. В таблице приведены значения Я 10 - 4См м2 / г экв при 25 С. [12]
Ионная проводимость: кислоты и амины. [13]
Ионная проводимость имеет большой температурный коэффициент, и числа переноса также зависят от температуры. Общее правило таково, что ион с более высокой проводимостью имеет более низкий температурный коэффициент; таким образом, при повышении температуры / к и t становятся почти равными. [14]
Ионная проводимость некоторых кристаллических тел - твердых электролитов - связана с особенностями строения кристаллической решетки и в отдельных случаях - с присутствием в ней чужеродных ионов. [15]
Страницы: 1 2 3 4
