Эквивалентная проводимость
Cтраница 1
 |
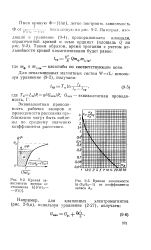
Зависимость эквивалентной электрической проводимости Я от VC для сильных ( / - КС1, 2 - LiCl и слабого ( 3 - СНзСООН электролитов. [1] |
Эквивалентная проводимость зависит от температуры. Для большинства электролитов проводимость увеличивается с повышением температуры, что объясняется увеличением скорости движения ионов в растворе. [2]
Эквивалентная проводимость е - ВоД заметно превышает эквивалентные проводимости всех ионов, за исключением Н3О и ОН -, в связи с чем механизм диффузии его отличается от механизма других ионов. Предполагают, что электрон перемещается в растворе путем очень быстрых переходов из одной ловушки растворителя в другую. [3]
Эквивалентная проводимость растет при повышении температуры со скоростью-2 % / С. Точное значение температурного коэффициента эквивалентной проводимости зависит от природы электролита, температуры и концентрации. В работе / 8 / фактические значения температурного коэффициента изменяются в пределах 0 1 - 9 % / С. [4]
Эквивалентная проводимость возрастает с уменьшением концентрации вещества и достигает при разбавлении раствора некоторого предельного значения Яо. При разбавлении степень диссоциации слабых электролитов возрастает и стремится к единице, и Ci - - C; при разбавлении сильных электролитов ослабевает взаимное притяжение ионрв разного заряда. [5]
Эквивалентная проводимость электролитов находится в прямой зависимости от разбавления раствора. Аррениус объяснил это явление постепенным увеличением числа ионов в растворе: по мере уменьшения концентрации все большее число молекул растворенного вещества диссоциирует на ионы. Он считал также, что эквивалентная проводимость раствора при данном разбавлении Ау пропорциональна степени электролитической диссоциации электролита в этом растворе. [6]
 |
Кривая зависимости потока от отношения 1 / [ ( / ш у - - ( / а. ].| Кривая зависимости In ( ka / Ra-1 от коэффициента запаса ka. [7] |
Эквивалентная проводимость рабочих зазоров и проводимости рассеяния приближенно могут быть найдены по среднему значению коэффициента рассеяния. [8]
Эквивалентная проводимость растворов сильного электролита яри экстраполировании к бесконечному разбавлению равна сумме значений подвижности ионов в растворе. В отличие от случаев, когда отдельные величины слагаемых определяются по их сумме лишь с учетом более или менее произвольных допущений, в вычислениях значений ионной подвижности по эквивалентной проводимости необходимость в подобных допущениях отпадает. Это обусловлено возможностью непосредственного измерения по числам переноса соотношения значений ионной подвижности. [9]
Эквивалентную проводимость растворов электролитов можно разбить на части, соответствующие ионам различного знака, непосредственно измеряя числа переноса. Однако для вязкости не существует величины, которая соответствовала бы числу переноса. [10]
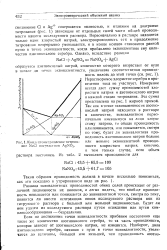 |
Конду ктометрпческое титрование NaCl посредством AgNO3. [11] |
Разница эквивалентных проводимостей обеих солей происходит от различной подвижности их анионов, и легко видеть, что вообще проводимость повышается или понижается до эквивалентной точки, смотря по тому, появится ли вместо исчезающих ионов исследуемого раствора ион из титрующего раствора с большей или меньшей подвижностью. Будет ли ион удален из исследуемого раствора путем осаждения или путем ком-плексообразования - безразлично. [12]
Значение эквивалентной проводимости при бесконечном разбавлении Кы ( а следовательно, и подвижности катиона и аниона) для данного электролита зависит от природы растворителя. [13]
Оценка эквивалентной проводимости на единицу длины gH по известной проводимости g при малых плотностях тока в протяженных заземлителях затрудняется ввиду изменения во времени и в пространстве напряжения и зависимости этого распределения от удельной проводимости и длины заземлителя. [14]
Зависимость эквивалентной проводимости от концентрации электролита описывается лредельным законом Онзагера в хорошем соответствии с экспериментальными измерениями лишь при сильном разбавлении электролита. [15]
Страницы: 1 2 3 4