Молярная проводимость
Cтраница 1
Молярная проводимость X в таблице выражена в ( См - м2) / моль. [1]
Величина молярной проводимости его раствора соответствует диссоциации на четыре иона, причем при взаимодействии с нитратом серебра легко осаждаются три иона хлора. С точки зрения Вернера этим данным отвечает формула лутеохлорида [ Co ( NH3) 6 ] Clg. Главная валентность кобальта, или его степень окисления, равна трем и насыщена тремя ионами СГ, а побочная - координационное число - шести и насыщена шестью молекулами аммиака. [2]
АО характеризует предельную величину молярной проводимости при бесконечном разбавлении. [3]
АО характеризует предельную величину молярной проводимости при бесконечном разбавлении. А, относится к релаксационному, а АЦ - к электрофоретическому эффектам. [4]
Единица молярной электрической проводимости СГС равна молярной проводимости раствора, имеющего молярную концентрацию 1 моль / см3 вещества с удельной проводимостью 1 ед. [5]
Координационная формула комплексных соединений может быть определена рядом методов, в том числе рентгеноструктурным - по молярной проводимости, реакциями двойного обмена. В случае использования метода двойного обмена при взаимодействии, например, раствора [ Р1 ( МНз) в ] С14 с раствором AgNOs весь содержащийся в нем хлор ( 4С1 -) осаждается в виде хлорида серебра; в соединении [ Pt ( МНз) 4С12 ] С12 AgNOs осаждается только два хлорид-иона ( 2С1 -); раствор [ Pt ( МНз) 2С14 ] не дает осадка с AgNOa. В анионном комплексе K2 [ PtCle ] нитрат серебра также не осаждает AgCl, но аналитически можно установить наличие в растворе ионов калия. Из полученных данных легко можно сделать вывод с подтверждением формул приведенных комплексов. [6]
Из сравнения формул (9.51) и ( 9.51 а) следует, что численно эквивалентная проводимость в п раз больше молярной проводимости. [7]
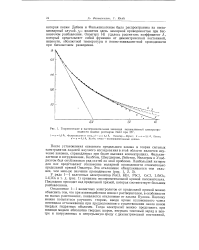 |
Теоретические и экспериментальные значения эквивалентной электропроводности водных растворов Nad при 25. [8] |
Дебаем и Фалькенхагеном была распространена на нестационарный случай. Дсо является здесь молярной проводимостью при бесконечном разбавлении. Онзагеру [4] удалось рассчитать коэффициент А, который представляет собой функцию от диэлектрической постоянной, вязкости, абсолютной температуры и ионно-эквивалентной проводимости при бесконечном разведении. [9]
При этом в ходе эксперимента обнаруживается, что проводимость как функция напряженности электрического поля увеличивается с ростом Е и стремится при высоких напряженностях поля к предельному значению. Это значение для молярной проводимости близко к соответствующему значению при бесконечном разбавлении. Концентрация влияет на эффект только в том отношении, что по мере разбавления раствора кривая становится круче. Справедливо также, что чем выше валентность электролита, тем в более резкой форме проявляется данный эффект. [10]
При разведении степень сольватации электронов увеличивается ( х растет), их подвижность значительно уменьшается и наблюдается резкое падение электропроводности раствора. При еще больших разведениях степень сольватации перестает изменяться, но степень диссоциации продолжает расти, что приводит к подъему молярной проводимости. Такую высокую проводимость можно объяснить главным образом специфической природой анионов ( еольнатированных электронов), для которых еще в большей степени, чем для протонов, вероятен цепочечнь и механизм проводимости Гротгу-са, а также меньшей вязкостью жидкого аммиака по сравнению с водой. Таким образом, проводимость растворов металлов в жидком аммиаке представляет собой особый случай электропроводности электронно-ионного, или смешанного, типа. В зависимости от состава раствора относительная доля электронной и ионной проводимости может изменяться в широких пределах. [11]
При разведении степень сольватации электронов увеличивается ( к растет), их подвижность значительно уменьшается и наблюдается резкое падение электропроводности раствора. При еще больших разведениях степень сольватации перестает изменяться, но степень диссоциации продолжает расти, что приводит к подъему молярной проводимости. Предельное значение молярной электропроводности в жидком аммиаке при бесконечном разведении в несколько раз превосходит молярную проводимость водных растворов электролитов в тех же условиях. Такую высокую проводимость можно объяснить главным образом специфической природой анионов ( сольватированных электронов), для которых еще в большей степени, чем для протонов, вероятен цепочечный механизм проводимости Гротгу-са, а также меньшей вязкостью жидкого аммиака по сравнению с водой. Таким образом, проводимость растворов металлов в жидком аммиаке представляет собой особый случай электропроводности электронно-ионного, или смешанного, типа. В зависимости от состава раствора относительная доля электронной и ионной проводимости может изменяться в широких пределах. [12]
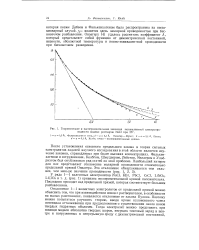 |
Теоретические и экспериментальные значения эквивалентной электропроводности водных растворов Nad при 25. [13] |
После установления основного предельного закона в теории сильных электролитов задачей научного исследования в этой области является изучение законов, справедливых при более высоких концентрациях. Фалькенхагеном и сотрудниками, Келбгом, Шмудцером, Лейстом, Меллером и Ульбрихтом был опубликован ряд статей по этой проблеме. Наибольший интерес для нас представляет отклонение молярной проводимости относительно предельной прямой Онзагера. [14]
При разведении степень сольватации электронов увеличивается ( к растет), их подвижность значительно уменьшается и наблюдается резкое падение электропроводности раствора. При еще больших разведениях степень сольватации перестает изменяться, но степень диссоциации продолжает расти, что приводит к подъему молярной проводимости. Предельное значение молярной электропроводности в жидком аммиаке при бесконечном разведении в несколько раз превосходит молярную проводимость водных растворов электролитов в тех же условиях. Такую высокую проводимость можно объяснить главным образом специфической природой анионов ( сольватированных электронов), для которых еще в большей степени, чем для протонов, вероятен цепочечный механизм проводимости Гротгу-са, а также меньшей вязкостью жидкого аммиака по сравнению с водой. Таким образом, проводимость растворов металлов в жидком аммиаке представляет собой особый случай электропроводности электронно-ионного, или смешанного, типа. В зависимости от состава раствора относительная доля электронной и ионной проводимости может изменяться в широких пределах. [15]
Страницы: 1 2