Продукт - азосочетание
Cтраница 2
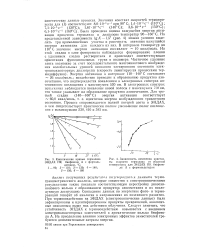 |
Кинетические кривые термолиза ЭНДАХ ПК бисфенола А с формальдегидом, С.| Зависимость изменения константы скорости термолиза от обратной температуры для ЭНДАХ ПК бисфенола А с формальдегидом. [16] |
Анализ полученных результата подгнерждаекл данными термо-гравиметрического анализа, которые совместно с спектроскопическими результатами также показали соответствующую перестройку диазохи-нонового кольца с образованием продуктов азосочетания и их последующую деструкцию. Совпадение данных по энергетике фото - и термореакций говорит об аналогии в направлениях их поэтапного развития. При термовоздействии на ЭНДАХ ( спектроскопические данные) были зафиксированы и идентифицированы продукты превращений, аналогичные описанным выше под действием облучения. Следует заметить, что устойчивость ЭНДАХ к гермовоздействию повышается с введением злектроноакцепторных заместителей в ароматические кольца бисфено-ла А. На преодоление влияния электронных эффектов заместителей требуются дополнительные затраты энергии. [17]
За ходом азосочетания следят по пробе на вытек и добавляют новую порцию диазосоединения лишь тогда, когда проба показывает отсутствие в реакционной смеси свободного диазосоединения. Продукт азосочетания, вследствие малой растворимости в реакционной смеси, выделяется сам или его выделяют высаливанием, иногда подкислением. Однако некоторые продукты азосочетания представляют собой не только азокрасители, они могут быть использованы как исходные продукты для получения химико-фармацевтических препаратов. [18]
Наконец, черные красители этой группы можно получить, применяя в качестве азосоставляющей амины нафталинового ряда. Краситель Ацетонорастворимый черный является продуктом азосочетания диазотированного 5-нитро - 2-аминофенола с 2-нафтиламино - 1-сульфокислотой. Он выпускается в виде кобальтового комплекса. [19]
Для получения фенола гидролизом гидросульфата бензол-диазония рекомендуется постепенно вводить раствор соли ди-азония в избыточное количество предварительно нагретой разбавленной серной кислоты, а не просто нагревать смесь раство-ров этих двух веществ. В противном случае побочно получается продукт азосочетания образовавшегося фенола с еще не разложившейся солью диазония. [20]
Для получения фенола гидролизом гидросульфата бензол-диазония рекомендуется постепенно вводить раствор соли диазония в избыточное количество предварительно нагретой разбавленной серной кислоты, а непросто нагревать смесь растворов этих двух веществ. В противном случае побочно получается продукт азосочетания образовавшегося фенола с еще не разложившейся солью диазония. В данной реакции обычно не используют бензолдиазонийхлорид, так как хлорид-ион будет конкурировать с водой на заключительной стадии реакции. [21]
Для получения фенола ( реакция 1) рекомендуется постепенно вводить раствор соли диазония в избыточное количество нагретой разбавленной серной кислоты, а не просто нагревать смесь растворов этих двух веществ. В последнем случае в качестве побочного получается продукт азосочетания образовавшегося фенола с неразложившейся солью диазония, а следовательно, выход фенола уменьшается. [22]
Которая в хлопковом масле гидролизуют щелочью и одновременно отгоняют с паром в изооктан, образующийся трифторметиланилин. Трифторметиланилин извлекают из изо-октана соляной кислотой, диазотируют и сочетают с а-нафтолом с последующим спектрофотометрическим определением при Я, - 520 нм продукта азосочетания. [23]
Большинство химических методов основано на реакциях восстановления нитрогруппы и гидролиза дихлорацетильного остатка. Так, например, хлорамфеникол определяют методом контролируемого восста новлсния ( титанометрически 1213 или полярографически 214 - 1218) или восстановлением избытком SnCl2, TiCla, Zn, Al, NiAl, Na2S2O4 с последующим определением ароматической аминогруппы диазотированием 12, 122, броматометрически 1213 1221, колориметрированием продукта конденсации с р-диметиламинобензальдегидом 22 и, наконец, колориметрированием продукта азосочетания с. Наконец, для качественного и количественного определения хлорамфеникола рекомендованы модифицированная биуретовая реакция 1242, цветные реакции с конц. [24]
Азосочетание чаще всего, но не всегда, необходимо заканчивать при значительном избытке азосоставляющей, чтобы в продукте не было свободного диазосоединения, которое своими вторичными превращениями может сильно осложнить реакцию, увеличив количество побочных и иногда трудно отделимых продуктов. Продукт азосочетания или выделяется сам вследствие его малой растворимости в реакционной смеси, или его выделяют высаливанием, иногда подкислением. [25]
В других классах красителей неоценимым методом для достижения глубоких тонов и высокой светостойкости выкрасок является обработка металлами соответственно замещенных азосоедине-ний. В последние годы значительно возрос интерес к компонентам азоидного крашения, имеющих комплексообразующие группировки. В первом были сделаны попытки использовать в качестве азосоставляющих уже готовые металлические комплексы азосоединений. Например, применялись медные комплексы 4-хлор - 2-аминофенол - резорцин, которые проявлялись солями диазония с образованием желтовато-коричневых оттенков. Исследованы другие варианты, которые включали использование продуктов азосочетания гетероциклические амины - - резорцин [234], например медные комплексы соединения 7-амино - 5-хлорбензимидазол т - резорцин, дающие с солями диазония коричневые и черные цвета. Этот метод пока находит ограниченное применение, вероятно, из-за того, что используемые азосоставляющие имеют слишком низкую субстантив-ность по сравнению с требуемой в азоидном крашении. [26]
Рассмотрение этого красителя поучительно с нескольких точек зрения. Известно, что прочность к валке при прочих равных условиях возрастала с величиной молекулы. К этому же приводит этилирование оксигрупп. С другой стороны, увеличение молекулы с сохранением сопряжения по леей длине цепи должно приводить к появлению субстантивных свойств, что для кислотных красителей нежелательно. Однако, несмотря на способность сульфидного мостика проводить электронные влияния, в данном случае из-за поворота бензольных ядер и вывода их из одной плоскости этого не происходит. Об этом же говорит относительно высокая окраска рассматриваемого красителя: по строению он, обладая большой молекулой и длинной цепью чередующихся простых и двойных связей, должен быть окрашен гораздо глубже, чем в желтый цвет. Однако цвет красителя примерно такой же, каким должен быть у половинки, например продукта азосочетания метаниловой кислоты с фенолом с последующим этилированием продукта сочетания. [27]
Дигидроксибензол, или гидрохинон, очень легко получается путем восстановления n - бензохинона. Он существует в природе в виде ( З - глюкопиранозида арбутина, который присутствует в листьях некоторых высших растений, например толокнянки обыкновенной Arbutus uva-ursi; найден также и метиларбутин. Впервые гидрохинон был получен в 1820 г. Пеллетье и Кавенту при перегонке хинной кислоты. Окисление гидрохинона было описано выше. В ходе окисления может происходить присоединение нуклеофилов, например в присутствии бисульфита получаются 2 - и 2 5-сульфоновые кислоты. Как и в случае пирокатехина, окисление гидрохинона из-за происходящих при этом реакций сочетания в конечном счете приводит к образованию продуктов типа гуминовых кислот. Замещение электрофилами не протекает столь легко, как в случае резорцина, однако в целом его исключать нельзя. Окисление может быть и помехой при синтезе, например диазосоединения реагируют с гидрохиноном с образованием в основном бензохинона, а не продуктов азосочетания. [28]
Дигидроксибензол, или гидрохинон, очень легко получается путем восстановления n - бензохинона. Он существует в природе в виде ( З - глюкопиранозида арбутина, который присутствует в листьях некоторых высших растений, например толокнянки обыкновенной Arbutus uva-ursi найден также и метиларбутин. Впервые гидрохинон был получен в 1820 г. Пеллетье и Кавенту при перегонке хинной кислоты. Окисление гидрохинона было описано выше. В ходе окисления может происходить присоединение нуклеофилов, например в присутствии бисульфита получаются 2 - и 2 5-сульфоновые кислоты. Как и в случае пирокатехина, окисление гидрохинона из-за происходящих при этом реакций сочетания в конечном счете приводит к образованию продуктов типа гуминовых кислот. Замещение электрофилами не протекает столь легко, как в случае резорцина, однако в целом его исключать нельзя. Окисление может быть и помехой при синтезе, например диазосоединения реагируют с гидрохиноном с образованием в основном бензохинона, а не продуктов азосочетания. [29]
Страницы: 1 2