Конечный продукт - замещение
Cтраница 1
Конечный продукт замещения образуется из о-комплекса 1 в результате разрыва ковалентной связи атома углерода кольца с атомом водорода, отщепляющимся в виде протона. Если разрыв связи осуществляется на. Изучение изотопных эффектов [271] показывает, что в большинстве реакций, электрофильного ароматического замещения отрыв протона происходит не на стадии, определяющей скорость-реакции. В реакциях нитрования, бромирования, азосочетания в стерически незатрудненное положение [271], сульфирования действием 50з в органических растворителях [272] отношение & H / & D мало отличается от единицы. [1]
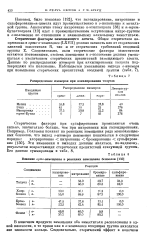 |
Распределение изомеров при алкилировании толуола. [2] |
В конечном продукте замещения оба заместителя расположены в одной плоскости, в то время как в - комплексе входящая группа находится вне плоскости кольца. [3]
Во второй стадии в случае бензола от псевдоалифатического атома углерода ст-комплекса быстро отщепляется протон и образуется конечный продукт замещения. У фенола в отличие от бензола в результате быстрого, практически мгновенного, отщепления протона от фенольного гидроксила ст-комплекса образуется дополнительный интермедиат с циклогексадиеноновой структурой - хинолид. Затем медленно, через протонированную форму, хинолид превращается в конечный продукт замещения. [4]
Гидротермическая переработка апатитового концентрата является многоступенчатым многофазным процессом, протекающим через стадию образования фазы переменного состава-фторгидроксилапатит. Конечным продуктом замещения является гидроксилапатит, распадающийся при высоких температурах и малом содержании водяного пара в газовой фазе на а-трикальцийфосфат и тетракальцийфосфат. [5]
В первом случае первоначально происходит присоединение нуклеофила к ароматич. Майзенхаймера), отщепление нуклеофуга от к-рого приводит к конечному продукту замещения. Электроноакцеп-торные заместители в ядре ( ЫО2 СОК, СМ и др.) стабилизируют интермедиат и способствуют быстрому протеканию р-ции. Так, если галоген в хлорбензоле можно заместить действием щелочи в очень жестких условиях ( 400 С; 4 5 МПа), то 2 4-динитрохлорбензол и 2 4 6-тринитрохлор-бензол реагируют с нуклеоф. [6]
Результаты удобно выражать следующим образом. У соответствующих центров ядра, подвергающегося замещению, надписывают числа, выражающие количество данного изомера, обнаруженного в конечном продукте замещения. Процентный состав изомеров, найденный путем анализа, не следует смешивать с выходами в процентах, которые могут быть практически достигнуты. Так, практически, при нитровании нитробензола может быть получен - и-динитробензол с выходом 88 %, но анализ всей реакционной массы показал, что количество мета-изомера составляет 93 %, а орто - и пара-изомеры присутствуют в количестве 6 и 1 % соответственно, как это обозначено на формуле. [7]
Результаты удобно выражать следующим образом. У соответствующих центров ядра, подвергающегося замещению, надписывают числа, выражающие количество данного изомера, обнаруженного в конечном продукте замещения. Процентный состав изомеров, найденный путем анализа, не следует смешивать с выходами в процентах, которые могут быть практически достигнуты. [8]
Важная роль этих факторов в реакциях нуклеофильного замещения в гетероароматнческом ряду была в полной мере понята на протяжении последних 10 - 15 лет, прежде всего благодаря низкотемпературной спектроскопии ЯМР. Естественно, строение конечного продукта замещения должно зависеть от того, в каких условиях проводится реакция. [9]
Во второй стадии в случае бензола от псевдоалифатического атома углерода ст-комплекса быстро отщепляется протон и образуется конечный продукт замещения. У фенола в отличие от бензола в результате быстрого, практически мгновенного, отщепления протона от фенольного гидроксила ст-комплекса образуется дополнительный интермедиат с циклогексадиеноновой структурой - хинолид. Затем медленно, через протонированную форму, хинолид превращается в конечный продукт замещения. [10]
Для реакций нуклеофильного замещения у ер2 - гибридного ацильного атома углерода реализуется двухстадийный механизм присоединения - отщепления. В первой стаднн нуклеофильный агент присоединяется к производному карбоновой кислоты с образованием заряженного ( для анионного нуклеофильного агента) или бетаниа ( для нейтрального нуклеофильного агента) тетраэдрического интермедиата. Во второй стаднн от этого интермедиата отщепляется в виде аниона или нейтральной молекулы уходящая группа Z и образуется конечный продукт замещения. [11]
Важная особенность а-комплексов - способность к изомеризации, которая может протекать или внутримолекулярно за счет 1 2-перемеще-ний заместителя из геминального узла при электрофильной атаке в уже замещенное положение ( шгсо-атака), или межмо-лекулярно. Ранее при анализе позиционной селективности на, основе факторов парциальной скорости ( см. выше) принимали, что соотношение получаемых конечных продуктов замещения отражает соотношение - скоростей образования изомерных а-комплексов, т.е. что кинетический контроль реакции совпадает с термодинамическим. Необходимость учета лтсо-атаки и изомеризации шгсо-о-компдекеов заставляет подвергнуть ревизии накопленные данные. [12]
Такая реакция идет в две стадии. Она начинается с диссоциации галогеналкила на ионы под влиянием молекул растворителя. Скорость этой диссоциации чрезвычайно мала и определяет скорость всей реакции замещения. Образующийся при диссоциации карбониевый ион, имеющий плоское строение, в дальнейшем быстро взаимодействует с реагентом или молекулой растворителя ( что более вероятно), образуя конечный продукт замещения, состоящий из равных количеств стереоизо-меров ( рацемат) ( см. гл. Такой механизм реакции называется мономолекулярным нуклеофильным замещением и обозначается символом SN. Реакциям с таким механизмом благоприятствуют большая полярность растворителя и устойчивость карбкатиона, которая зависит от участия заместителя ( алкильных групп) в распределении положительного заряда за счет - ( - / - эффекта этих групп. Чем больше водородных атомов в метилыюй группе замещено на радикалы [ например, в случае трет-бутила ( СН3) зС - ], тем равномернее распределение этого заряда по всем углеродным атомам карбкатиона и тем более стабилен этот ион. Следует, однако, отметить, что рассмотренные механизмы реакции замещения являются крайними проявлениями реального процесса. [13]
Присоединение метилат-иона протекает обратимо по двум направлениям: быстро - в положении 3, с образованием термодинамически менее стабильного 1 3-а-комплекса ( комплекс К. Первый преобладает при кинетическом, второй - при термодинамическом контроле реакции. Более высокую стабильность 1 1-с-комплексов связывают с уменьшением стерического напряжения вследствие вывода алкокси-группы или другой группы Z из копланарности с нитрогруппами в opmo - положении. При отщеплении уходящей группы из 1 1-с-комплекса образуется конечный продукт замещения. [14]
Присоединение метилат-иона протекает обратимо по двум направлениям: быстро - в положении 3, с образованием термодинамически менее стабильного 1 3-а-комплекса ( комплекс К. Первый преобладает при кинетическом, второй - при термодинамическом контроле реакции. Более высокую стабильность 1 1-а-комплексов связывают с уменьшением стерического напряжения вследствие вывода алкокси-группы или другой группы Z из копланарности с нитро-группами в o / wio - положении. При отщеплении уходящей группы из 1 1-а-комплекса образуется конечный продукт замещения. [15]
Страницы: 1