Пропиленкарбонат
Cтраница 3
По отношению к АО пропиленкарбонат является дифференцирующим растворителем, ДМСО - нивелирующим. В пропиленкарбонате СоС12 проявляет эффективные акцепторные свойства по отношению к АО. На основании полученных данных самым эффективным акцептором по отношению к АО является TiCl4, который имеет наиболее экранированный заряд на центральном атоме, а хлорид никеля эффективен по отношению к НАС. Уменьшение эффективности действия в вышеприведенных рядах хлоридов коррелирует со степенью экранирования заряда в центральном атоме. [31]
Из этилен - и пропиленкарбонатов получены этиленсульфид и пропилеисульфид высокой степени чистоты и подобран эффективный катализатор для осуществления их полимеризации. Установлено, что полимеризация циклических тиоокисей инициируется катализаторами как катионного, так и анионного типов, но эффективный процесс полимеризации с получением высокомолекулярных полимеров может быть осуществлен на катализаторах анионного типа в присутствии полярных растворителей. [32]
Навески хинона растворяют в пропиленкарбонате, содержащем перхлорат тетраэтиламмония или перхлорат лития. Удалив кислород, снимают циклические вольтамперограммы растворов. По разности потенциалов катодного и анодного пиков устанавливают степень обратимости первого и второго пиков хинона. [33]
Навески хинона растворяют в пропиленкарбонате, содержащем перхлорат тетраэтиламмония или перхлорат лития. Удалив кислород, снимают циклические вольтамиерограммы растворов. По разности потенциалов катодного и анодного пиков устанавливают степень обратимости первого и второго инков хинона. [34]
Отбор проб осуществляют концентрированием в пропиленкарбонат. [35]
Такие апротонные растворители, как пропиленкарбонат, могут оказаться весьма полезными при замещении бромом. Реакция со многими соединениями протекает быстро. При бромировании некоторых фенолов наблюдаются необычные стехиометри-ческие соотношения реагентов, а образование во многих случаях трибромидов увеличивает чувствительность метода. [36]
Но из раствора MgCl2 в пропиленкарбонате он не осаждается. Неплохие результаты получены при разряде магния из раствора NaClO4 Mg ( 2) в ацетонитриле и LiBr Mg ( 2) в пропиленкарбонате. [37]
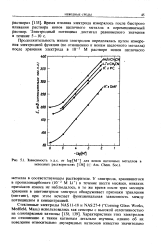 |
Зависимость э.д.с. от log [ M ] для ионов щелочных металлов в неводных растворителях Am. Chem. Soc.. [38] |
У электрода, хранившегося в пропиленкарбонате ( 10 - 2 М Li) в течение шести месяцев, никаких признаков износа не наблюдалось, в то же время после трех месяцев хранения в ацетонитриле электрод обнаруживает признаки травления ( питтинг), при этом исчезает функциональная зависимость между потенциалом и концентрацией. [39]
 |
Сравнение Kj 2 неэлектролитов в разных растворителях с к % 3 тех же жидких неэлектролитов при 298 К. [40] |
С другой стороны, в пропиленкарбонате сжимаемость растет с увеличением неполярной части молекулы спирта. Это подтверждает особый характер взаимодействия в системах вода - углеводороды. При более высоких температурах инкременты неполярных групп становятся положительными и растворы ведут себя в большей степени как обычные. [41]
Из других неводных растворителей получили распространение пропиленкарбонат, нитрометан, метиленхлорид, ацетон. [42]
Данные табл. 6 показывают, что пропиленкарбонат и хлор-пропиленкарбонат по своей экстрагирующей способности значительно превосходят диэтиленгликоль. [43]
В качестве растворителей оказалось возможным использовать пропиленкарбонат, этиленкарбонат, диметилсульфоксид, бутиро-лактон, метилформиат, тетрагидрофуран, ацетонитрил, этиленгли-кольсульфит. В табл. 33 показана удельная электропроводность таких электролитов, она приблизительно на один порядок меньше, чем у применяемых водных электролитов. [44]
В апротонной среде ( ацетонитрил, пропиленкарбонат) окисление протекает по двум необратимым одноэлектронным стадиям, а в присутствии доноров протонов ( пикриновой кислоты) процесс меняется, становясь двухэлектронным и обратимым. [45]
Страницы: 1 2 3 4