Процесс - диссоциация - молекула
Cтраница 1
Процесс диссоциации молекулы нередко облегчается наличием твердой поверхности. Известны случаи, когда активные центры реакции - атомы или радикалы - зарождаются на поверхности и затем инициируют реакции, происходящие в объеме. Так, если направить друг на друга нагретые до 520 С струи водорода и кислорода, то реакция между ними не происходит; реакцию удается вызвать только при температуре газов выше 560 С. Но если в пересечении газовых струй водорода и кислорода ввести нагретый до 520 С кварцевый стержень, происходит взрыв. [1]
Процесс диссоциации молекулы на атомы по первому механизму похож на рассмотренный нами процесс индуцированной диссоциации. Возможность такого процесса передачи энергии подтверждается тушением с помощью кислорода флуоресценции красителей, адсорбированных на поверхности твердых тел. [2]
Процессы диссоциации молекул при высоких температурах ( а также и ионизации атомов), описанные в § 41, могут служить иллюстрацией к принципу Ле-Шателье применительно к этому кругу явлений. К таким процессам применимы все термодинамические соотношения, связывающие АЯ, Д5, ДО, константу равновесия, а также и другие величины. [3]
Процессы диссоциации молекул при высоких температурах ( а также и ионизации атомов), описанные в § 41, могут служить иллюстрацией к принципу Ле-Шателье применительно к тому кругу явлений. К таким процессам применимы все термодинамические соотношения, связывающие ДЯ, Д5, ДО, константу равновесия, а также и другие величины. [4]
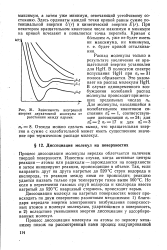 |
Зависимость внутренней. [5] |
Процесс диссоциации молекулы нередко облегчается наличием твердой поверхности. Известны случаи, когда активные центры реакции - атомы или радикалы - зарождаются на поверхности и затем инициируют реакции, происходящие в объеме. Так, если направить друг на друга нагретые до 520 С струи водорода и кислорода, то реакция между ними не происходит; реакцию удается вызвать только при температуре газов выше 560 С. Но если в пересечении газовых струй водорода и кислорода ввести нагретый до 520 С кварцевый стержень, происходит взрыв. [6]
Процесс диссоциации молекулы на атомы по первому механизму похож на рассмотренный нами процесс индуцированной диссоциации. Возможность такого процесса передачи энергии подтверждается тушением с помощью кислорода флуоресценции красителей, адсорбированных на поверхности твердых тел. [7]
Процессы диссоциации молекул при высоких температурах ( а также и ионизации атомов), описанные в § 41, могут служить иллюстрацией к принципу Ле-Шателье применительно к этому кругу явлений. К таким процессам применимы все термодинамические соотношения, связывающие ЛЯ, Д5, ДО, константу равнрвесия, а также и другие величины. [8]
Процесс диссоциации молекул электролита на ионы обратим, сольваты противоположно заряженных ионов, сталкиваясь между собой в растворе и испытывая притяжение благодаря наличию у них разноименных зарядов, могут вновь соединяться между собой, образуя сольваты молекул. [9]
 |
Эквивалентные схемы растворения водорода в металле. [10] |
Процесс диссоциации молекул газа всегда идет с затратой энергии и теплоты адсорбции и растворения не могут компенсировать расход энергии на разрыв молекулярных связей. [11]
Процесс диссоциации молекул слабого электролита на ионы представляет собой процесс обратимый: образовавшиеся соль-ваты противоположно заряженных ионов испытывают взаимное притяжение и, сталкиваясь друг с другом при своем движении, могут снова соединяться, образуя сольватированную молекулу. [12]
Сравнение процесса диссоциации молекул различных галогенов провели Вике и Франк; они показали, что при диссоциации фтора изменение энтропии оказывается больше, чем для остальных галогенов. Значительное изменение энтропии при диссоциации фтора Fz 2 F объясняется особой устойчивостью электронной структуры молекулы фтора. Вследствие этого число вращательных и колебательных уровней молекулы фтора сравнительно невелико, а следовательно, остается очень небольшим и соответствующее значение энтропии молекулярного фтора. Поэтому при появлении возможности поглощения энергии за счет поступательной энергии образовавшихся атомов энтропия увеличивается в большей степени. Эта относительно более сильная диссоциация фтора - одна из причин его большей реакционной способности. [13]
В процессе диссоциации молекул образуются как положительные, так и отрицательные ионы. [14]
В процессе диссоциации молекул образуются как положительные, так и отрицательные ионы. Количества вещества, выделенные на электродах в разных ваннах, будут одинаковыми. [15]
Страницы: 1 2 3 4