Процесс - медленная коагуляция
Cтраница 1
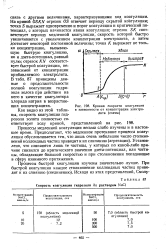 |
Кривая скорости коагуляции в зависимости от концентрации электролита ( схема. [1] |
Процессы медленной коагуляции весьма слабо изучены и в настоящее время. Установлено, что слипаются лишь те частицы, у которых по какой-либо причине снизился до критического значения дзета-потенциал, или частицы, обладающие большой скоростью и при столкновении попадающие в сферу взаимного притяжения. [2]
Процессы медленной коагуляции изучены сравнительно мало. [3]
Если экспериментальная k меньше вычисленной, то это указывает на протекание в системе, процесса медленной коагуляции. В условиях же быстрой коагуляции, продолжающейся секунды и доли секунды, экспериментальная и теоретическая константы должны иметь одинаковые значения. [4]
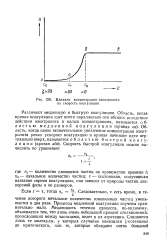 |
Влияние концентрации электролита на скорость коагуляции. [5] |
Следовательно, т есть время, в течение которого начальное количество взвешенных частиц уменьшается в два раза. Процессы медленной коагуляции изучены сравнительно мало. Медленность течения процесса, по-видимому, объясняется тем, что лишь очень небольшой процент столкновений, происходящих между частицами, ведет к их агрегации. [6]
Хотя такие агрегаты легко разрушаются и представляют собою короткие анизометрические частицы, сам факт их образования, как нам кажется, имеет принципиальное значение. Проведение процесса медленной коагуляции дисперсий в условиях наложения электрического поля должно способствовать необратимой агрегации и облегчать образование нитевидных частиц. Можно, например, вводить в дисперсию поливинилацетата раствор танина в такой концентрации, которая при обычных условиях не вызывает быстрой коагуляции. При легком перемешивании образовавшейся волокнистой массы первоначальная ориентация волокон нарушается. При этом они изгибаются и подвергаются значительным деформациям, но целостность их не нарушается. Таким образом, они обладают вполне ощутимой прочностью. Дальнейшее изучение возможностей данного метода может представить интерес с точки зрения разработки физико-химических путей получения волокнисто-пористых материалов. [7]
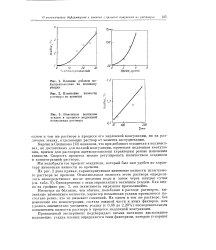 |
Влияние добавок ме-тилцеллозольва на величину усадки.| Изменение вязкости раствора во времени.| Изменение величины усадки в процессе медленной коагуляции раствора. [8] |
Несмотря на большие, чем обычно, колебания в расходе растворов, вызванные изменением вязкости, характер повышения усадки проявляется настолько резко, что не вызывает сомнений. На одном и том же растворе, без изменения его концентрации, состава жидкой части и иных факторов, нам удалось значительно увеличить усадку ( с 0 68 до 2 20 %) последовательным повышением вязкости раствора в процессе медленной коагуляции. [9]
Как было указано выше, в ряде случаев определению стабильности коллоидного раствора щелочного металла препятствует процесс металлизации. Этот процесс, приводящий к выделению всего коллоида в виде металла, не следует идентифицировать с обычным понятием стабильности коллоида как такового. Процесс металлизации и процесс медленной коагуляции золя протекают параллельно, причем в тех случаях, когда скорость первого процесса превышает скорость второго, мы наблюдаем выделение металла без промежуточного образования геля. [10]
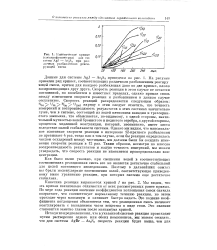 |
Кинетические кривые ( сшктрофотометрия для системы AgJ - As. S3 при различных разбавлениях реагирующей смеси. [11] |
На рисунке приведен ряд кривых, соответствующих различным разбавлениям реагиру ющей смеси, причем для каждого разбавления дано по две кривых, плохо воспроизводящих друг друга. Скорость реакции в этом случае не остается постоянной, но колеблется в известных пределах, однако прямая связь между изменением скорости реакции и разбавлением в данном случае отсутствует. Скорость реакций распределяется следующим образом: Чи ] х / 2о х / 5о х / 12 ( ь наряду с этим следует отметить, что точность измерений и воспроизводимость результатов в этих системах значительно хуже, чем в системе, состоящей из золей пятиокиси ванадия и трехсерни-стого мышьяка, что объясняется, по-видимому, с одной стороны, значительной мутностью золей бромистого и йодистого серебра, с другой стороны, процессом медленной коагуляции, который, несомненно, имеет место вследствие малой стабильности системы. Однако мы видим, что максимальное изменение скорости реакции в интервале 12-кратного разбавления не превышает 4 раз, тогда как в том случае, если бы реакция определялась числом соударений между частицами, мы должны были бы ожидать изменения скорости реакции в 12 раз. Таким образом, несмотря на плохую воспроизводимость результатов и малую точность измерений, мы можем утверждать, что скорость реакции не изменяется пропорционально концентрации. [12]
При изучении явления коагуляции в зависимости от прибавления электролита -, было обращено внимание на то, что раз начавшийся процесс коагуляции быстро или медленно приводит систему к выделению осадка. Такое изменение системы было названо скрытой коагуляцией. Состояние скрытой коагуляции обнаруживается по увеличению внутреннего трения золя и переходу ламинарного трения в структурное. Скрытая коагуляция, разумеется, очень часто предшествует выделению осадка. В некоторых случаях прибавление электролита к золям вызывает не выделение осадка, а желатинирование всей массы раствора. Это явление протекает постепенно, напоминая процесс медленной коагуляции. Так, например, желатинируют золи кремнекислоты, гидроокиси алюминия и церия под действием электролитов. Подобно обычной коагуляции, этот процесс также необратим я подчиняется правилу ШульцеТарди. [13]
Ортокинетическая коагуляция заключается в увеличении скорости столкновения частиц сверх скоростей, обусловленных броуновским движением, возникающим из-за различных скоростей движения больших и малых частиц в гравитационном поле или при конвекции. Этот эффект ясно демонстрируется, например, в дисперсиях угольной сажи, к которым добавляют определенное количество соли, чтобы вызвать медленную коагуляцию. В некоторых случаях золи, медленно коагулирующие при стоянии, мгновенно коагулируют при интенсивном встряхивании. Такой эффект является автокаталитическим, так как при росте агрегатов неравенство скоростей увеличивается. В типичных эмульсиях с размером капель 0 1 - 10 мкм и более ортокинетическая коагуляция может быть более важной, чем обычная коагуляция. Поэтому ни теория Смолуховского, ни любое ее усовершенствование не применимы к процессам быстрой и медленной коагуляции. [14]
Ортокинетическая коагуляция заключается в увеличении скорости столкновения частиц сверх скоростей, обусловленных броуновским движением, возникающим из-за различных скоростей движения больших и малых частиц в гравитационном поле или при конвекции. Этот эффект ясно демонстрируется, например, в дисперсиях угольной сажи, к которым добавляют определенное количество соли, чтобы вызвать медленную коагуляцию. В некоторых случаях золи, медленно коагулирующие при стоянии, мгновенно коагулируют при интенсивном встряхивании. Такой эффект является авто каталитическим, так как при росте агрегатов неравенство скоростей увеличивается. В типичных эмульсиях с размером капель 0 1 - 10 мкм и более ортокинетическая коагуляция может быть более важной, чем обычная коагуляция. Поэтому ни теория Смолуховского, ни любое ее усовершенствование не применимы к процессам быстрой и медленной коагуляции. [15]
Страницы: 1 2