Процесс - паровая конверсия - метан
Cтраница 1
Процесс паровой конверсии метана протекает в трубчатой печи 8, в которой расположены в 12 рядов 504 реакционные трубы. Паровая конверсия в трубчатой печи 8 осуществляется на никелевом катализаторе при 830 С на выходе. [1]
Интенсивность процесса паровой конверсии метана с водяным паром лимитируется скоростью подвода теплоты к зоне протекания процесса. [2]
Интенсивность процесса паровой конверсии метана с водяным паром лимитируется скоростью подвода теплоты к зоне протекания процесса, Нанесение активных компонентов катализатора непосредственно на металлический сплав, имеющий более высокие теплопроводные свойства, чем оксидный носитель, увеличит скорость теплопередачи, а следовательно, и образования водорода. [3]
На рис. 7 представлены результаты расчетев по сложной ( 16) и простой ( 12) из табл. 3 моделям для процесса паровой конверсии метана. [4]
В данной работе изучено влияние пористой структуры глиноземного носителя на дисперсность нанесенного никелевого катализатора и роль дисперсности металла на его активность в процессе паровой конверсии метана. [5]
Как следует из уравнения кинетики ( 18), скорость конверсии метана парами воды ( при их избытке) пропорциональна парциальному давлению СН4 и обратно пропорциональна парциальному давлению водорода. Следовательно, процесс паровой конверсии метана контролируется его второй стадией - реакцией взаимодействия метана с поверхностью катализатора. [6]
 |
Элементы, входящие в состав промоторов катализаторов конверсии углеводородов. [7] |
В табл. 7 - 9 группа физически осажденных катализаторов представлена исключительно нанесенными катализаторами. Эти катализаторы широко применяются в процессах паровой конверсии метана и других газообразных и жидких углеводородов. [8]
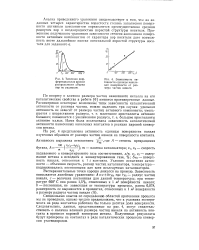 |
Типичная дифференциальная кривая распределения объема пор по радиусам.| Зависимость активности единицы никелевой поверхности от размера частиц никеля. [9] |
Специальных опытов по определению областей протекания процесса мы не проводили, однако трудно предположить, что в условиях эксперимента на ряде контактов работала бы только десятая доля поверхности. Следовательно, данные, представленные на рис. 4, могут свидетельствовать о наличии влияния размера частиц никеля на активность контакта в процессе паровой конверсии метана. Полученные результаты будут проверены на контактах в ряде каталитических процессов конверсии углеводородов. [10]
Однако ири такой температуре скорость реакции окисления метана водяным паром очень мала. Реакция протекает с значительной скоростью лишь при температурах 1350 С и выше. Из-за трудности ведения эндотермического процесса лрк столь высоких температурах в промышленных условиях процесс паровой конверсии метана ведут на катализаторе в при сутствии избытка водяного пара по сравнению со стехиомет-рическим количеством. В табл. 11 приведен рассчитанный Б. П. Корниловым равновесный состав газовой смеси, образующейся в процессе паровой конверсии метана при различных температурах и давлениях и соотношении СН4: Н201: 2 в исходной газовой смеси. [11]
Однако при такой температуре скорость реакции окисления метана водяным паром очень мала. Реакция протекает с значительной скоростью лишь при температурах 1350 С и выше. Из-за трудности ведения эндотермического процесса при столь высоких температурах в промышленных условиях процесс паровой конверсии метана ведут на катализаторе в присутствии избытка водяного пара по сравнению со стехиомет-рическим количеством. В табл. 11 приведен рассчитанный Б. П. Корниловым равновесный состав газовой смеси, образующейся в процессе паровой конверсии метана при различных температурах и давлениях и соотношении СН: Н2О1: 2 в исходной газовой смеси. [12]
Однако ири такой температуре скорость реакции окисления метана водяным паром очень мала. Реакция протекает с значительной скоростью лишь при температурах 1350 С и выше. Из-за трудности ведения эндотермического процесса лрк столь высоких температурах в промышленных условиях процесс паровой конверсии метана ведут на катализаторе в при сутствии избытка водяного пара по сравнению со стехиомет-рическим количеством. В табл. 11 приведен рассчитанный Б. П. Корниловым равновесный состав газовой смеси, образующейся в процессе паровой конверсии метана при различных температурах и давлениях и соотношении СН4: Н201: 2 в исходной газовой смеси. [13]
Однако при такой температуре скорость реакции окисления метана водяным паром очень мала. Реакция протекает с значительной скоростью лишь при температурах 1350 С и выше. Из-за трудности ведения эндотермического процесса при столь высоких температурах в промышленных условиях процесс паровой конверсии метана ведут на катализаторе в присутствии избытка водяного пара по сравнению со стехиомет-рическим количеством. В табл. 11 приведен рассчитанный Б. П. Корниловым равновесный состав газовой смеси, образующейся в процессе паровой конверсии метана при различных температурах и давлениях и соотношении СН: Н2О1: 2 в исходной газовой смеси. [14]
Страницы: 1