Процесс - политермическая кристаллизация
Cтраница 1
 |
Политерма четырехкомпонентной системы. [1] |
Процесс политермической кристаллизации в случае отсутствия взаимодействия между компонентами системы рассмотрен ниже. Процессы, в которых принимают участие кристаллогидраты и двойные соли, будут рассмотрены при описании применения физико-химического анализа в технологии некоторых продуктов, получаемых из галургического сырья. [2]
Изучено снятие пересыщения в процессе совместной политермической кристаллизации азотнокислого калия и двухромовокислого калия по отношению к обоим солям при различном исходном их содержании в растворе и в разных температурных интервалах кристаллизации. [3]
Изложены результаты подхода к расчету процесса изотермической и политермической кристаллизации Ba ( NOsh из азотнокислых и водных растворов при постоянном пересыщении. Показано, что проведение кристаллизации при постоянном пересыщении снимает флуктуации скоростей роста, благоприятно влияет на сглаживание поверхности кристаллов и уменьшает возможность возникновения замкнутых полостей и капилляров, содержащих маточный раствор, тем самым повышая чистоту продукта. Составлены программы изо-и политермической кристаллизации. [4]
Исследовано фракционирование ряда микропримесей в процессе политермической кристаллизации алюмоаммонийных квасцов при перемешивании с выходом - 90 % и с последующей промывкой кристаллов водой в количестве 40 % от веса кристаллов. [5]
Из вышеописанных условий проведения опытов явствует, что осаждение азотнокислого калия и соосаждение примесей происходило в процессе политермической кристаллизации. В ходе политермической кристаллизации образование кристаллов начиналось, как только возникающее в результате снижения температуры пересыщение раствора становилось достаточно большим. [6]
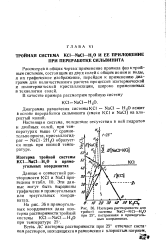 |
Изотерма растворимости для тройной системы NaCl - KC1 - HtO при 25, построенная в прямоугольных координатах. [7] |
Рассмотрев в общих чертах применение правила фаз ктрой-ным системам, состоящим из двух солей с общим ионом и воды, и их графическое изображение, перейдем к применению диаграмм для количественного расчета процессов изотермической и политермической кристаллизации, широко применяемых в технологии солей. [8]
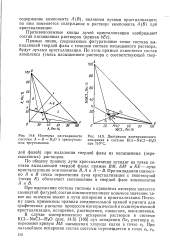 |
Изотерма растворимости системы А - В - Н2О в прямоугольном треугольнике.| Диаграмма изотермического испарения в системе КС1 - NaCl - Н2О при 110 С. [9] |
При выражении состава системы в процентах изотерма является замкнутой фигурой, состав компонентов имеет конечное значение; такое же значение имеют и лучи испарения и кристаллизации. Поэтому здесь применимы правила соединительной прямой и рычага для графических расчетов процессов изотермической и политермической кристаллизации, испарения, растворения, смешения, высаливания. [10]
При кристаллизации в интервале температур 60 - 20 величина К не имеет ясно выраженной тенденции к росту или уменьшению с изменением времени перемешивания раствора. Подобная зависимость К от времени перемешивания объясняется, по-видимому, тем, что в процессе политермической кристаллизации захват примесей определяется рядом одновременно действующих факторов. [11]
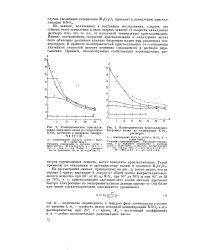 |
Политермическая кристаллизация бихромата калия из содержащих KN03 растворов в интервале температур 60 20.| Политермическая кристаллизация. [12] |
Из данных, полученных в настоящем исследовании, следует, что степень этого замедления в свою очередь зависит от скорости охлаждения раствора или, что то же, от начальной температуры кристаллизации. Именно соотношением скоростей кристаллизации и охлаждения может быть объяснено различное влияние бихромата калия при различных температурах. В процессе политермической кристаллизации от соотношения указанных скоростей зависит величина создаваемого в растворе пересыщения. [13]
Страницы: 1