Процесс - ионный обмен
Cтраница 2
 |
Коэффициенты распределения некоторых веществ в двухкомпонентных системах несмешивающихся жидкостей при 25 С.| Схема действия ионообменного устройства для умягчения воды. [16] |
Процесс ионного обмена играет чрезвычайно важную роль в механизме снабжения растений питательными веществами из почвы. Чаще всего растения нуждаются в таких минеральных веществах, в состав которых входят ионы К, Са2 и Mg2; эти ионы попадают в растения из входящего в состав почвы глинозема ( см. разд. Обычно в обмен на минеральный катион растения отдают ион Н, что приводит к повышению кислотности почвы. [17]
Процессы ионного обмена обратимы. [18]
Процесс ионного обмена обусловлен наличием в ионите активных групп, сообщающих ему кислотный или щелочной характер. [19]
Процесс ионного обмена может быть представлен следующей схемой. [20]
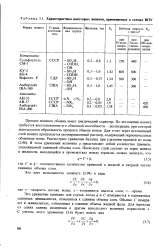 |
Характеристика некоторых ионитов, применяемых в схемах ВПУ. [21] |
Процесс ионного обмена имеет циклический характер. По истощении ионита требуется восстановление его обменной способности-регенерация, при которой используется обратимость процесса обмена ионов. Для этого через истощенный слой ионита пропускается регенерационньш раствор, содержащий первоначальные обменные ионы. В этом уравнении величина q представляет собой количество примеси, улавливаемой единицей объема слоя. [22]
Процесс ионного обмена может, в принципе, происходить с любым электролитом, в котором ионы одного знака связаны с нерастворимой структурой, а ионы противоположного знака способны диссоциировать из структуры в раствор. Степень диссоциации такого вещества при контакте с водой обычно слишком мала, и ее нельзя определить химическими методами из-за образования двойного слоя на поверхности. Растворенные ионы - их называют противоионами - удерживаются вблизи поверхности электрическим полем, возникающим при их удалении из твердой фазы. Однако, если в водной среде присутствуют другие растворенные соли, они могут смешиваться с противоионами и частично или полностью замещать их при удалении твердой фазы из жидкости. Это основа всех ионообменных процессов: электрический двойной слой включается в истинный ионный обмен. [23]
Процесс ионного обмена может, в принципе, происходить с любым электролитом, в котором ионы одного знака связаны с нерастворимой структурой, а ионы противоположного знака способны диссоциировать из структуры в раствор. Степень диссоциации такого вещества при контакте с водой обычно слишком мала, и ее нельзя определить химическими методами из-за образования двойного слоя на поверхности. Растворенные ионы - их называют противоионами - удерживаются вблизи поверхности электрическим нолем, возникающим при их удалении из твердой фазы. Однако, если в водной среде присутствуют другие растворенные соли, они могут смешиваться с противо-ионами и частично или полностью замещать их при удалении твердой фазы из жидкости. Это основа всех ионообменных процессов: электрический двойной слой включается в истинный ионный обмен. [24]
Процесс ионного обмена является многоступенчатым и состоит из диффузии иона к поверхности зерна ионита, диффузии иона внутри зерна, акта ионного обмена и диффузии вытесненного иона в раствор. Скорость ионного обмена определяется главным образом скоростью диффузионных процессов внутри зерен ионита. [25]
Процессы ионного обмена находят широкое применение в промышленности для технологических целей и в лабораторной практике для решения аналитических задач. Поэтому в настоящее время разработаны методы получения ряда синтетических ионитов с наперед заданными свойствами, а производство ионитов достигает значительных размеров. [26]
Процесс ионного обмена осуществляют в колоннах, в которых обеспечивается хороший контакт сорбента с обрабатываемым раствором. [27]
Процесс ионного обмена широко известен в связи с его применением для умягчения воды. Впервые он был использован для разделения неорганических катионов и анионов. Позже были сделаны попытки применить хроматографиче-скую теорию к ионнообменной адсорбции. Получены смолы с кислыми свойствами для катионного обмена и смолы с основными свойствами для анионного обмена. Адсорбция этими смолами в значительной мере определяется зарядом растворенного вещества ( при этом надо отметить, что обменная адсорбция представляет собой очень сложный процесс), а для элюирования применяются растворы кислоты, щелочи или соли. Другими примерами применения ионного обмена могут служить анализ нуклеиновой кислоты, 103 адсорбция алкалоидов 104 и отделение свободных сульфо-кислот от азокрасителей с SOsNa-группами в молекуле. Ричардсон наблюдал, что свободные сульфокислоты Небесно-голубого FF и других высокомолекулярных красителей быстро адсорбируются ионнообменной смолой Деацидит В. С уменьшением величины молекулы может быть достигнут такой предел, при котором начинается медленная диффузия в структуру смолы. [28]
 |
Некоторые ионообменные смолы. [29] |
Процесс ионного обмена в основе своей есть процесс диффузионный, и стадией, определяющей его скорость, может быть либо диффузия ионов через жидкую пленку, непосредственно прилегающую к частице смолы, либо диффузия ионов внутри пор частицы. Первый фактор доминирует при работе с разбавленными растворами, второй - при работе с концентрированными растворами или в случае объемистых ионов. Сродство ионов к тому или иному типу смолы зависит от многих факторов, в том числе от валентности и размера иона, от концентрации, температуры и растворителя. В водных растворах низкой концентрации ( менее 0 1 экв) сродство к смоле повышается с увеличением валентности иона, а для ионов с одинаковой валечтностью - с уменьшением диаметра гидратированного иона. Точный порядок изменения сродства сильно зависит от конкретного вида смолы. [30]
Страницы: 1 2 3 4