Процесс - образование - феррит
Cтраница 1
 |
Средние значения теплоемкостей феррита натрия. [1] |
Процесс образования феррита может быть представлен в следующем виде. Заводская окись железа, содержащая в порах скелета гранул свежеосажденную активную форму Fe2O3 - H2O в смеси с содой ( частично гидратированной), поступая в феррит-ную печь, в которой у загрузочного отверстия температура топочных газов составляет 450 - 500, быстро нагревается. При этом кристаллогидраты соды плавятся и дегидратируются; образующийся расплав может проникать в поры окиси. При 500 РбзОз реагирует с едким натром, содержащимся в небольших количествах в заводской окиси. [2]
Так как процесс образования феррита наиболее вероятно начинается с растворения катионов Ме2 в зернах Рв2О3 и наоборот, целесообразно исследовать кинетику изменения коэффициента термоэдс в процессе растворения небольшого количества примеси Ме2 в гематите. Эксперимент проведен на Fe2O3 квалификации ос. [3]
Указанный ход процесса образования ферритов позволяет применить для сравнительного изучения кинетики образования ферритов лития, натрия и калия дери-ватографический метод. [4]
Энергия активации процесса образования феррита калия в смеси К2СО3: Fe2O3l: 1 в изотермических условиях составляет 56 2 ккал / моль, в пределах ошибки эксперимента совпадает со значением, полученным по данным измерений в неизотермических условиях по методу [10], и свидетельствует о воз-ложности применения дериватографического метода для изучения сложных гетерогенных процессов. [5]
Таким образом, процесс образования феррита и феррата ведет к потере активной массы отрицательного электрода. Поэтому в железо-никелевых аккумуляторах количество активной массы в отрицательных электродах должно быть гораздо больше теоретического. [6]
В производственных условиях процесс образования феррита натрия проходит в следующей последовательности: нагрев активной окиси железа. Эти процессы протекают в ферритной печи по мере перемещения материалов от загрузочной ее стороны к выгрузной. Соответственно изменяется и степень каустификации, как это показано на рис. 82, из которого видно, что образование феррита натрия протекает в последней трети печи, где происходит плавление соды. [7]
В производственных условиях процесс образования феррита натрия проходит в следующей последовательности: нагрев активной окиси железа Fe2O3 - H20 и частично гидратированной соды, дегидратация соды и окиси железа, взаимодействие окиси с едким натром, содержащимся в оборотной промытой окиси железа, поступающей на приготовление смеси, плавление соды с прониканием плава в поры Fe203 и образованием феррита натрия. Эти процессы протекают в ферритной печи по мере перемещения материалов от загрузочной ее стороны к выгрузной. Соответственно изменяется и степень каустификации, как это показано на рис. 82, из которого видно, что образование феррита натрия протекает в последней трети печи, где происходит плавление соды. [8]
Большое влияние на скорость процесса образования феррита оказывают также различные примеси, приводящие к частичному расплавлению какого-либо компонента, в результате чего облегчается взаимодействие между реагирующими веществами. [9]
Следует заметить, что на процесс образования ферритов существенное влияние оказывают такие факторы, как чистота исходных компонентов, их подготовка, состав газовой фазы и др. Установлено, что при синтезе NiFe2O4 из чистых NiO и Ре2Оз энергия активации составила 401 1 кДж / моль. [10]
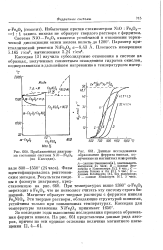 |
Приближенная диаграмма состояния системы NiO - Fe20s ( по Касседан.| Данные исследования образования феррита никеля, полученные из магнитных измерений. [11] |
За последние годы выполнены исследования процесса образования феррита никеля. [12]
Примеси в руде отрицательно влияют на процесс образования феррита натрия и его выщелачивание, а также на последующие стадии производства-выпарку щелоков и плавку едкого натра. В процессе обжига смеси при плавлении с содой примеси SiO2, A12O3, FeO, SOs и др. образуют легкоплавкие соединения, прилипающие к футеровке ферритных печей в виде колец. Соединения кальция и магния и другие невыщелоченные примеси остаются в окиси железа. В результате окись железа постепенно загрязняется всеми этими соединениями и теряет свою активность. В производственных условиях степень загрязнения окиси железа не должна превышать 6 - 8 %; при большем содержании примесей окись железа обновляется. В процессе производства окись железа изменяет свою физическую структуру. [13]
Приведены изотермы изменения коэффициента термоэдс в процессе образования ферритов меди и цинка из смеси окислов. Показано - влияние термической предыстории исходных окислов на скорость изменения термоэдс. Исследовано изменение термоэдс во времени неспеченных образцов гематита с добавкой 0 1; 0 5 1 0 мол. Наблюдается корреляция между радиусом катиона примеси и влиянием ее на коэффициент термоэдс гематита. Наибольшее влияние оказывают те примеси, радиус катиона которых незначительно отличается от радиуса катиона железа в гематите. [14]
Образующаяся в таких условиях окись углерода может восстанавливать Fe203, которая в процессе образования феррита натрия уже не участвует. [15]
Страницы: 1 2