Процесс - производство - сода
Cтраница 1
Процесс производства соды емкий по диоксиду углерода. Сода и ее водные растворы хорошо хранятся. [1]
В процессе производства соды в качестве одного из промежуточных продуктов образуется хлористый аммоний, который накапливается в фильтровой жидкости. При циклическом процессе хлористый аммоний разлагают, регенерируя аммиак для повторного использования его при аммонизации рассола. [2]
При реализации процесса производства соды из поваренной соли наблюдаются более сложные равновесия, в которых участвует, помимо аммиака, углекислого газа и воды, еще хлористый натрий. Для проведения расчетов процессов, протекающих при карбонизации, Шокиным и Соловьевой [44] был предложен метод определения состава жидкой и газовой фаз в системе NaCl NHs CO-2 НзО ЫаНСОз NH4C1 в зависимости от степени карбонизации. [3]
Никопа Леблан ( 1742 - 1806) изобретает процесс производства соды из поваренной соли. [4]
Если их предварительно не удалить, то в процессе производства соды при поглощении аммиака и двуокиси углерода из рассола будут выделяться в осадок плохо растворимые соединения - СаСО3, Mg ( OH) 2, NaCl - Na2CO3 - MgCO3, ( NH4) 2CO3 - MgCO3, что приведет к засорению аппаратуры, трубопроводов и готовой продукции - соды. Чтобы избежать этого, сырой рассол предварительно очищают от примесей в специально предназначенной для этого аппаратуре. [5]
Каковы бы ни были превращения иона Na в процессе производства соды, соответствующий ему ион С1 - остается в жидкости. Поступив с очищенным рассолом, он переходит в аммонизированный рассол, в жидкость колонн и фильтров, в конденсатор и теплообменник дестилляции, в смеситель и дестиллер и, наконец, уходит в отброс. Следовательно, по изменению концентрации хлор-иона в жидкостях легко определить относительное изменение их объемов. [6]
Если их предварительно не удалить, то в процессе производства соды при поглощении аммиака и углекислоты из рассола будут выделяться в осадок плохо растворимые соединения - СаСО3, Mg ( OH) 9, NaCl Na2CO3 MgCO3, ( NH4) 2CO3 MgCO3, что приведет к засорению аппаратуры, трубопроводов и готовой продукции - соды. Чтобы избежать этого, сырой рассол предварительно очищают от примесей в специально предназначенной для этого аппаратуре. [7]
Каковы бы ни были превращения иона Na в процессе производства соды, соответствующий ему ион С1 - остается в жидкости. Поступив с очищенным рассолом, он переходит в аммонизированный рассол, в жидкость колонн и фильтров, в конденсатор и теплообменник дестилляции, в смеситель и дестиллер и, наконец, уходит в отброс. Следовательно, по изменению концентрации хлор-иона в жидкостях легко определить относительное изменение их объемов. [8]
Датский химик Юпиус Томсен ( 1826 - 1909) изобретает процесс производства соды из криолита. [9]
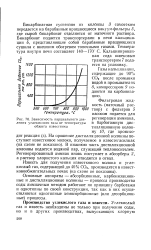 |
Зависимость парциального давления углекислого газа от температуры обжига известняка. [10] |
Основные аппараты - абсорбционные, карбонизационные и дистилляционные колонны - процесса производства соды аммиачным методом работают по принципу барботажа и однотипны по своей конструкции, так как в них осуществляются однотипные хемосорбционные ( или десорбцион-ные) процессы. [11]
Аммиак может быть использован также для производства нашатыря или хлористого аммония, получаемого в процессе производства соды по Сольвею. Известно, что по Сольвею, или, иначе называемому, аммиачному способу производства соды, аммиак, Действуя на раствор поваренной соли в присутствии углекислоты. [12]
Производство кальцинированной соды по аммиачному способу на различных содовых заводах осуществляется почти по одной и той же технологической схеме. Различны только конструкции, размеры и производительность отдельных групп аппаратов. Весь процесс производства соды можно разделить на несколько этапов, каждый из которьсх осуществляется в одном или нескольких ( соединенных между собой) аппаратах. [13]
Хлористый аммоний или нашатырь ( NH4C1) содержит 25 процентов азота и получается различными путями. Этот способ получения нашатыря иногда применяется на практике, но он не дает продукта должного качества и мало экономичен. Наиболее распространенным методом получения хлористого аммония является его выделение в процессе производства соды. [14]
Аммиак, образующийся при разложении хлористого аммония, называется связанным аммиаком. Процесс регенерации аммиака происходит в специальных аппаратах колонного типа, в которых поступающий сверху маточный раствор нагревается идущим ему навстречу паром. Пар отбирает свободный аммиак, а из нижней части аппарата вытекает раствор хлористого кальция. Газообразный аммиак освобождают от пара, который конденсируется при температуре 60 - 70 Цельсия, и направляют в абсорбер, на первую операцию процесса производства соды - приготовление аммиачно-соляного раствора. Следовательно, аммиак, используемый при традиционном способе, полностью регенерируется и совершает своего рода круговорот в производственном процессе. Конечно, известных потерь аммиака избежать при этом невозможно. Эти потери восполняются с помощью подачи газообразного аммиака или аммиачной воды в аппарат, в котором происходит регенерация аммиака. Однако при методе получения кальцинированной соды и хлористого аммония в качестве двух самостоятельных продуктов величина необходимых дополнительных поставок аммиака резко возрастает. Именно поэтому возникает нужда в установлении органических связей нового метода с процессом получения синтетического аммиака. Кроме того, отпадает необходимость в процессе обжига известняка. [15]
Страницы: 1