Процесс - адсорбция - кислород
Cтраница 2
Термодесорбционные спектры с одновременным масс - спектрометрическим анализом химического состава продуктов пиролиза указывают на наличие на поверхности УДА большого количества кислорода и кислород-содержащих частиц, а также о более высокой активности поверхности термообработанного УДА по отношению к процессу адсорбции кислорода, переходящему в диссоциативный процесс. [16]
Из данных, приведенных в табл. 114, видно, что при низких температурах поглотительная способность у фюзена выше, чем у других ингредиентов, при высоких же температурах наибольшей поглотительной способностью обладают витрен и кларен, Это объясняется тем, что при низких температурах происходит в основном процесс адсорбции кислорода. Фюзен, обладая клеточной структурой, отличается высокой адсорбционной способностью. При более высоких температурах процесс окисления значительно усиливается, поэтому ингредиенты, обладающие большей склонностью к окислению, поглощают больше кислорода. [17]
С, в каждой полости адсорбируются примерно 12 молекул кислорода. В данном случае процесс адсорбции кислорода идет также, как и на обычных адсорбентах - по мере понижения температуры быстро растет количество адсорбируемого кислорода. [18]
Результаты по кинетике адсорбции кислорода и воздействию на этот процесс паров воды представлены на рис. 13, где по оси ординат откладывается количество адсорбированного кислорода, а по оси абсцисс время в минутах. Кривая 1 соответствует процессу адсорбции кислорода на окисленнойповерхно-сти германия. Кривая 2 показывает, как изменяется кинетика адсорбции кислорода на той же поверхности германия после ее обработки парами воды. [19]
Нельзя ли найденные Йетсом различия между процессами адсорбции кислорода и аргона, с одной стороны, и азота - с другой, объяснить большим квадруполышм моментом азота. [20]
Сато и Акамату [139] установили, что щелочные металлы повышают хемосорбцию кислорода на углероде и ослабляют связи углерод - углерод на его поверхности, увеличивая скорость сгорания. С другой стороны, они сообщают о том, что фосфор, будучи катализатором для процесса адсорбции кислорода на углероде, затрудняет освобождение поверхностного окисла. [21]
Тепловой эффект активированной адсорбции кислорода, по данным Гар - нера9 и Ки10, приближается к теплотам образования окислов углерода. Кейер и Рогинским12 показано, что поверхность активного сахарного угля должна рассматриваться как энергетически неоднородная с экспоненциальным распределением участков по энергиям активации для процесса адсорбции кислорода. [22]
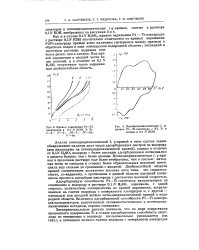 |
Кривые заряжения Pt-Ti - электродов в 0 1 N КОН, % Ti. 1 - 3. Я-5. III-7. IF-10. V-40. [23] |
Анализ потенциодинамической I, ф-кривой в этом случае также обнаруживает наличие двух типов адсорбционных центров по водороду ( два максимума на потенциодинамической кривой), однако в отличие от 0 1N H2SO4 водорода с более высоким адсорбционным потенциалом в щелочи больше, чем с более низким. Потенциодинамическая /, ф-кри-вая в щелочном растворе еще более необратима, чем в кислом: катодная ветвь ее смещена в сторону более отрицательных значений потенциала еще сильнее по сравнению с анодной. Двойнослойной области кривой соответствует достаточно высокая еила тока, что свидетельствует, по-видимому, о протекании в данной области значений потенциала процесса адсорбции кислорода с достаточно высокой скоростью. [24]
Позднее изучалось34 35 равновесие в системе окись серебра - кислород в интервале температур 302 - 445 С и 374 - 500 С. При изучении3 равновесия и кинетики процесса адсорбции кислорода на серебре в интервале 170 - 200 СС подтвердилось предположение, что при взаимодействии кислорода с серебром образуется окись серебра Ag2O, мопомолекулярный слой которой образуется на поверхности металла. [25]
Максвелл и Грин [28] обнаружили, что кислород адсорбируется на поверхности ( 111), уже покрытой атомарным водородом. Однако кинетика адсорбции кислорода сильно отличается от адсорбции кислорода на чистой поверхности ( 111) германия. Начальная скорость адсорбции значительно меньше, а предельная адсорбция существенно больше. Образование воды в ходе адсорбции кислорода не было обнаружено. Что происходило с адсорбционным водородом, трудно сказать. Возможно, в процессе адсорбции кислорода образовывались гидрсокисные или гидроперекисные комплексы. [26]
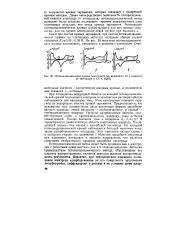 |
Потенциодинамические кривые платинового ( а, иридиевого ( б и родиевого ( в электродов в 4 6 н. HaS04. [27] |
При потенциалах водородной области на анодной потенциодинами-ческой кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается невыясненной. Низкие значения тока в интервале Ег 0 4 - - 0 7 В характеризуют двоинослоиную область платинового водорода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [28]
При потенциалах водородной области на анодной потенциодина-мической кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается не выясненной. Низкие значения тока в интервале фг 0 4 - н 0 7 в характеризуют двойнослойную область платинового электрода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [29]
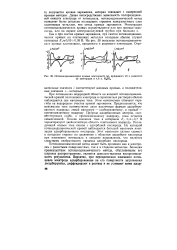 |
Потенциодинамические кривые платинового ( а, иридиевого ( б и родиевого ( в электродов в 4 6 н. HaS04. [30] |
Страницы: 1 2 3